Досвід використання дексмедетомідину для седації в умовах відділення реанімації у пацієнтів з пневмоніями
Резюме. Доволі давно відомий досвід використання дексмедетомідину з метою седації при порушеннях дихання різного ступеня важкості. У цій статті буде розглянуто два клінічних випадки, в яких використовувався дексмедетомідин для переведення та з наступною адаптацією пацієнтів до штучної вентиляції легень. Метою роботи є оцінка ефективності та глибини седації при різних ступенях порушення дихання, а також вплив дексмедетомідину на дихання.
Ключові слова: дексмедетомідин, штучна вентиляція легень, пневмонії, седація.
Вступ
За даними Всесвітньої організації охорони здоров’я (ВООЗ), нові форми вірусних захворювань продовжують з’являтися і є викликом для охорони здоров’я. За останні двадцять років було зафіксовано кілька вірусних епідемій, таких як коронавірус тяжкого гострого респіраторного синдрому (SARS-CoV) у 2002–2003 роках, вірус грипу H1n1 у 2009 році та коронавірус близькосхідного респіраторного синдрому (MERS-CoV) у 2012 році.
Сьогодні новий коронавірус тяжкого гострого респіраторного синдрому (SARS-CoV-2) є причиною пандемії, коронавірусної хвороби-2019 (COVID-19), яка уражує тисячі людей у всьому світі. Прояви респіраторного синдрому при зараженні COVID-19 можуть варіювати від повної відсутності симптомів до тяжкої пневмонії з дихальною недостатністю, що може призвести до смерті.
Найчастішим і найважчим ускладненням у пацієнтів з COVID-19 є гостра гіпоксична дихальна недостатність або гострий респіраторний дистрес-синдром (ГРДС), що вимагають кисневої та вентиляційної терапії [1]. Пацієнтам у критичному стані необхідна інтубація та проведення штучної вентиляції легень [1, 2].
Вплив дексмедетомідину на дихання. Дексмедетомідин із самого початку застосовувався як препарат для довготривалої седації в нейрохіругічному профілі у відділеннях інтенсивної терапії [3]. Дексмедетомідин має седативний і анксіоліотичний ефект, який дозволяє зберігати контакт з пацієнтом для оцінки неврологічного статусу навіть в умовах ШВЛ. Venn і співавт. виконали ретроспективний аналіз впливу Дексмедетомідину на дихальну функцію у післяопераційних пацієнтів після екстубації в умовах ВРІТ (n = 33).
Між групами плацебо і дексмедетомідину протягом 6 годин після екстубації були відсутні статистично значущі відмінності сатурації, яка вимірювалася методом пульсоксиметрії (p = 0,26), і частоти дихання (p = 0,16). Крім того, були відсутні відмінності показників pH артеріальної крові (p = 0,77) і PaCO2 (p = 0,75) за цей же 6-годинний період як між групами, так і всередині групи дексмедетомідину [14].
Також дексмедетомідин подовжує тривалість моторної і сенсорної блокади місцевих анестетиків більш ніж у 2 рази. У понад 66 % пацієнтів дексмедетомідин знижує потребу в післяопераційному морфіні [4]. Має місце зменшення потреби в опіоїдах, частіше не відбувається пригнічення дихання, це може бути необхідним для пацієнтів, які дихають самостійно, або які відлучаються від апарата ШВЛ.
Дексмедетомідин викликає унікальний стан, який має назву “кооперативна седація”. Таким чином, можна спостерігати за станом критично важких пацієнтів кожного дня, для оцінки рівня седації, аналгезії, неврологічних та дихальних функцій.
В результаті цього можна сказати, що дексмедетомідин є просто незамінним препаратом для седації пацієнтів, які перебувають на ШВЛ.
Клінічний випадок № 1
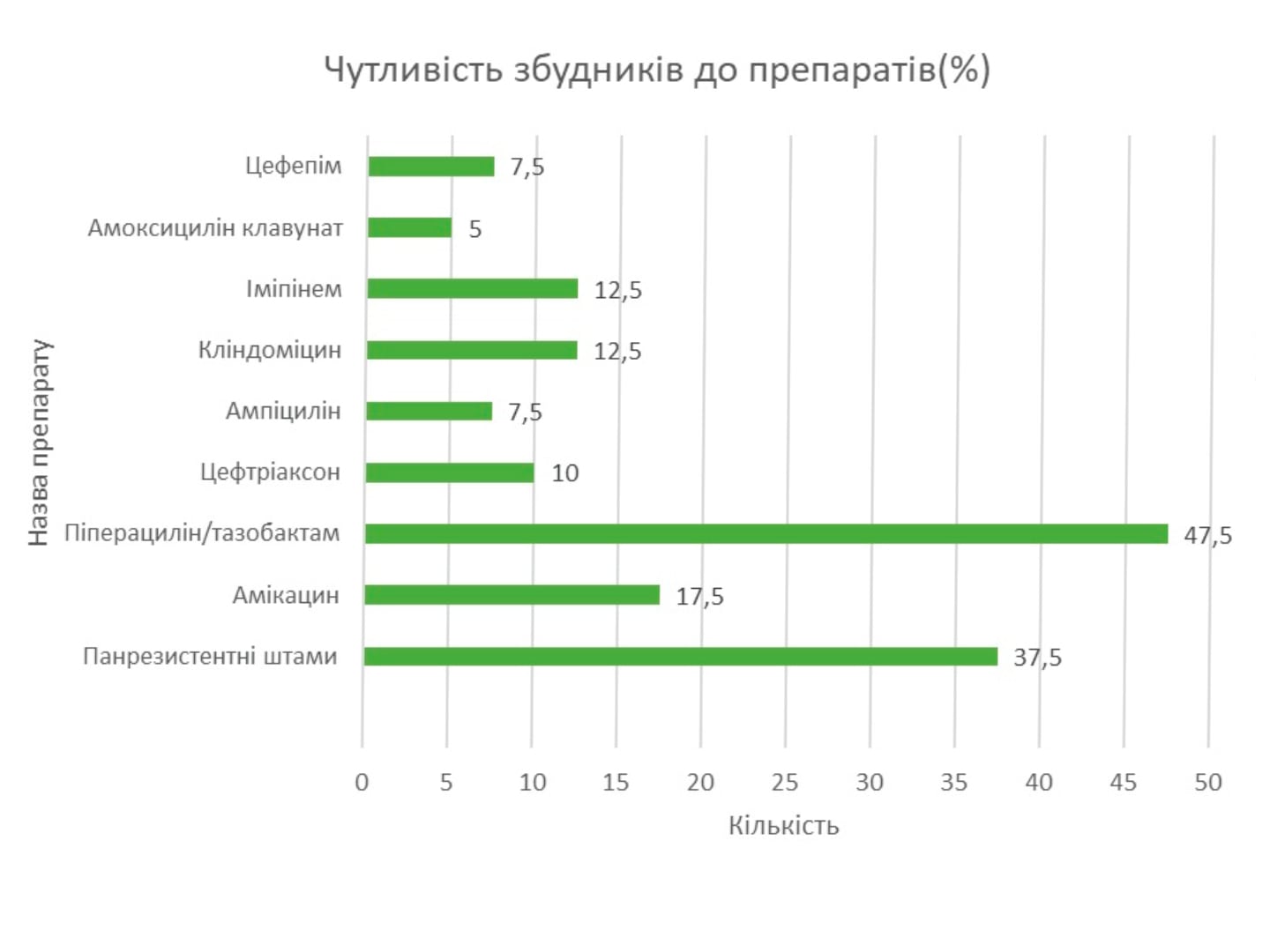
Пацієнт С. віком 45 р., 75 кг, із ЦД ІІ типу надійшов до Вінницького клінічного ендокринологічного високоспеціалізованого центру 11 березня 2020 р. зі скаргами на 3-денну субфебрильну лихоманку, кашель, задишку, дискомфорт у ділянці грудної клітки, нежить, втому. Було виконано Ro ОГП – ознаки двобічної прикореневої інфільтрації (рис. 1).
Рис. 1. Рентгенографія ОГК (пряма проекція)
Через 6 днів клінічна картина погіршилась, температура підвищилась до 38,8 °С, наросла задишка.
Хворого перевели до відділення інтенсивної терапії. Об’єктивно–шкіраблідо-рожевогокольору,ЧД–28/хв., SpO2 – 93 %. Аускультативно – симетричне ослаблене
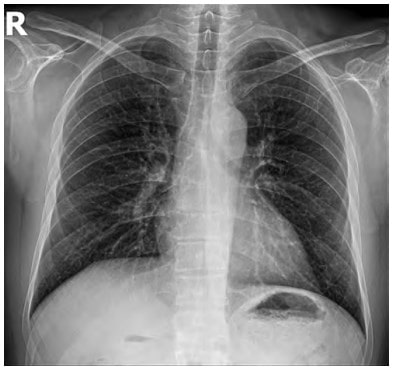
везикулярне дихання. АТ – 130/80 мм рт. ст. Ps – 96/хв., ритмічний задовільний. Було повторно виконано Ro ОГП – прикоренева інфільтрація посилилась (рис. 2). CITO TEST Influenza A + B – негативний.
Рис. 2. Рентгенографія ОГК (пряма проекція)
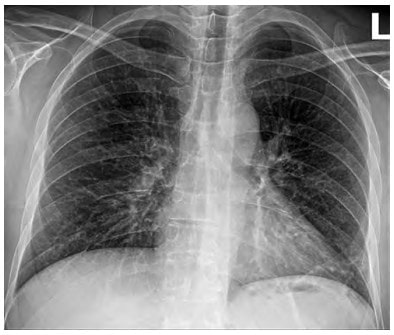
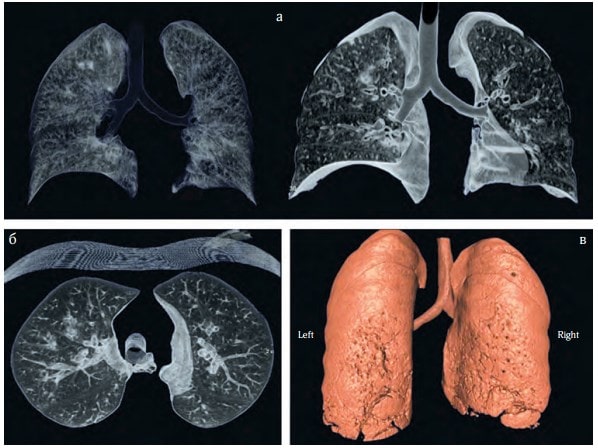
Хворому розпочато оксигенотерапію через лицьову маску з потоком 7 л/хв. Розпочали рестриктивну інфузійну терапію (20 мл/кг/добу), з антибіотиків було призначено Цефтріаксон по 1 г 2 рази на добу. Протягом 2 днів лікування стан хворого не покращився – було виконано КТ легень, на якому були ознаки вірусної пневмонії (рис. 3, 4):
• ділянки зниження прозорості легеневої тканини по типу матового скла;
• неоднорідні ділянки консолідації паренхіми;
• вузликові вогнищеві тіні.
Після обстеження було проведено корекцію лікування – призначено Озельтамівір – по 75 мг 2 р/д, Азитроміцин – 500 мг 1 р/д, Амікацин 500 мг – 1 р/д, згідно з мікробіологічним паспортом відділення [4].
Враховуючи те, що ЧД до 32/хв., SpO2 – 92 % (на інсуфляції О2), було вирішено не очікувати подальшого погіршення стану і дотриматись принципу ранньої інтубації трахеї та переводу пацієнта на штучну вентиляцію легень. Пацієнта після аналгоседації Фентанілом та Пропофолом перевели на ШВЛ апаратом Hamilton C1 в режимі AdaptiveSupportVentilation (ASV), з постійною інфузією дексмедетомідину (Юрія-Фарм) у дозуванні 0,2 мкг/кг/год. Хворий перебував у стані седації (шкала RASS-1–2), але був доступний контакту. Завдяки дексмедетомідину та вибраному режиму апарата, пацієнт вдало адаптувався до апарата.
У даному клінічному випадку початково ми встановили наступні параметри:
• MinVol – 160 %;
• PEEP – 12 см вод. ст.;
• FiO2 – 50 %.
Рис. 3. КТ-сканування легень: а – сканування у прямій проекції та в поперечному розрізі; б – сканування в боковій проекції
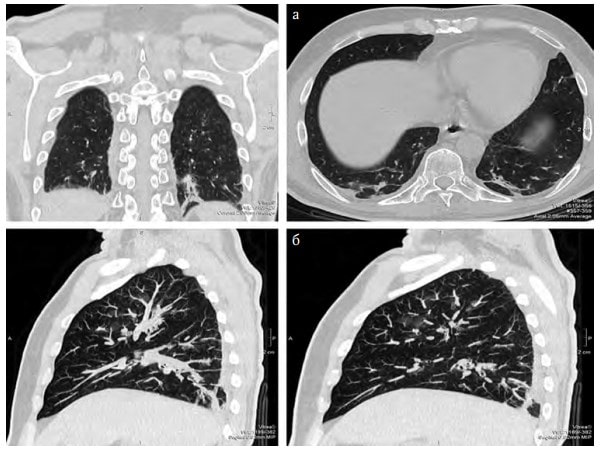
Рис. 4. КТ-сканування з 3D-реконструкцією легень (а – в прямій проекції, б – поперечний зріз, в – 3D-реконструкція)
В режимі ASV апарат вдало адаптувався до спроб спонтанного дихання пацієнта. З наступного дня почала покращуватись клініко-лабораторна картина. Поступово зменшували ступінь респіраторної підтримки. Показники газообміну та налаштування параметрів ШВЛ на Hamilton C1 – див. табл. 1.
Таблиця 1. Параметри вентиляції та газообміну у пацієнта
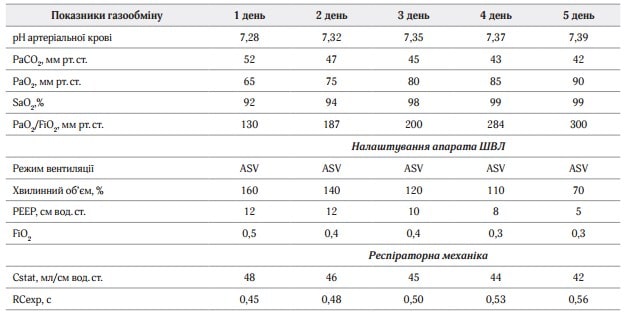
Під час усього періоду вентиляції в режимі ASV усереднені показники відповідали протективним відповідно до ARDSnet-протоколу:
• ДО – 6,5 мл/кг ІМТ (4–8 мл/кг ІМТ по ARDSnet-протоколу);
• тиск плато (Рплато) – 23 см вод. ст. (Рплато < 30 см вод. ст. по ARDSnet-протоколу);
• driving pressure – 9 см вод. ст. (< 15 см вод. ст. по ARDSnet-протоколу).
На 5-ту добу перебування пацієнта на ШВЛ у зв’язку з активізацією спонтанного дихання та покращення показників дихальної механіки було вирішено розпочати відлучення від респіратора. % MinVol почали знижувати нижче 100 %, PEEP знижено до 5 см вод.ст., FiO2 – до 30 %. Після 30 хвилин спостереження за пацієнтом вентиляційні показники не погіршувались, тому вирішили провести тест спонтанного дихання з наступними параметрами:
• MinVol – 25 % (Psup ≈ 5 см вод. ст.);
• PEEP – 5 см вод. ст.;
• FiO2 – 25 %.
З наступного дня почала покращуватись клініколабораторна картина. Поступово зменшували ступінь респіраторної підтримки.
Після цього за пацієнтом активно спостерігали протягом 40 хвилин – вентиляційний статус не погіршився, тому було прийнято рішення екстубувати хворого. Екстубація пацієнта проводилась у свідомості, не припиняючи інфузійного введення Дексмедетомідину. В подальшому лікування проводилось згідно з листом призначень і на 10 добу лікування пацієнта було переведено в соматичний стаціонар.
Клінічний випадок № 2
Пацієнт Р. віком 35 років надійшов зі скаргами на субфебрильну лихоманку, задишку, кашель, втому. Було виконано Ro ОГП – ознаки однобічної прикореневої інфільтрації. Через 1 день у хворого на фоні інтоксикації почали з’являтись напади делірію. Хворого було переведено у реанімаційне відділення.
На фоні основної терапії з метою седації було прийнято рішення використовувати Дексмедетомідин (Юрія-Фарм), позаяк у хворого виникли порушення дихання: збільшення частоти дихання, кашель, незначний ціаноз. Введення Дексмедетомідину (Юрія-Фарм) проводилось за наступною схемою: навантажувальна інфузія 1 мкг/кг протягом 10 хвилин, підтримуюча інфузія – 0,6 мкг/кг/год.
Напади делірію почали виникати все менше, і на 3-й день у хворого не виникло жодного випадку делірію. Через 4 дні лікування хворого було переведено до соматичного відділення.
Обговорення
Делірій є гострим психоневрологічним синдромом, який характеризується порушенням мислення, когнітивними дисфункціями й уражує до 80 % пацієнтів, які перебувають у відділенні інтенсивної терапії [5]. Лікування делірію є критично важливим, тому що для важких пацієнтів це впливає на їхїній подальший стан. На даний момент делірій має найбільший вплив на стан пацієнтів, тривалість перебування на апаратах штучної вентиляції легень, а також на тривалість перебування пацієнта у відділенні інтенсивної терапії [6, 7, 8].
Причини, які призводять або прискорюють виникнення делірію, включають в себе: седативні препарати, ГАМК-ергічні агенти, які порушують процеси пам’яті або сну [9]. Бензодіазепіни змінюють архітектуру сну і знижують фазу повільного сну [10]. Дексмедетомідин зберігає фазу повільного сну [11]. Таким чином, він менше впливає на когнітивну функцію.
Є два клінічних дослідження, які підтверджують цю теорію. Дослідження SEDCOM показало меншу розповсюдженість делірію в групі, у якій застосовувався дексмедетомідин, ніж в групі, у якій застосовували мідазолам [12]. У дослідженні MEnDS оцінювалась кількість днів без делірію. В групі, у якій застосовувався дексмедетомідин, кількість днів була вища, ніж у групі, в якій застосовувався лоразепам [13]. Дексмедетомідин впливає на фазу сну; таким чином, сон стає більш фізіологічним, а седація – більш заспокійливою.
Можна зробити висновок, що дексмедетомідин зменшує кількість випадків виникнення делірію у хворих, які перебувають у відділенні інтенсивної терапії, а також зменшує тривалість делірію. Вищеописане дозволяє рекомендувати Дексмедетомідин (Юрія-Фарм) для профілактики та лікування делірію.
Автори:
Дмитрієв Д. В., Бортник Д. І., Дмитрієва К. Ю, Мельниченко М. О., Вінницький національний медичний університет ім. М. І. Пирогова
Література:
- Yang X, Yu Y, Xu J, Shu H, Xia J, Liu H, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. The Lancet Respiratory Medicine [Internet]. Elsevier BV; 2020 May;8(5):475–81. Available from: https://doi.org/10.1016/s2213–2600(20)30079–5
- Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 novel Coronavirus–Infected Pneumonia in Wuhan, China. JAMA [Internet]. American Medical Association (AMA); 2020 Mar 17;323(11):1061. Available from: https:// doi.org/10.1001/jama.2020.1585
- Precedex (dexmedetomidine hydrochloride) injection. For intravenous use. — Prescribing information. LakeForest, IL, USA: HospiraInc. 2011.
- Arain SR, Ruehlow RM, Uhrich TD, Ebert TJ. The Efficacy of Dexmedetomidine Versus Morphine for Postoperative Analgesia After Major Inpatient Surgery. Anesthesia & Analgesia [Internet]. Ovid Technologies (Wolters Kluwer Health); 2004 Jan;153–8. Available from: https://doi. org/10.1213/01.ane.0000 093225.39866.75
- Jacobi J, Fraser GL, Coursin DB, Riker RR, Fontaine D, Wittbrodt ET, et al. Clinical practice guidelines for the sustained use of sedatives and analgesics in the critically ill adult. Critical Care Medicine [Internet]. Ovid Technologies (Wolters Kluwer Health); 2002 Jan;30(1):119–41. Available from: https://doi.org/ 10.1097/00003246–200201000– 00020
- Riker RR. Dexmedetomidine vs Midazolam for Sedation of Critically Ill Patients<subtitle>A Randomized Trial</subtitle>. JAMA [Internet]. American Medical Association (AMA); 2009 Feb 4;301(5):489. Available from: https://doi.org/10.1001/jama.2009.56
- Ely EW. Delirium as a Predictor of Mortality in Mechanically Ventilated Patients in the Intensive Care Unit. JAMA [Internet]. American Medical Association (AMA); 2004 Apr 14;291(14):1753. Available from: https://doi.org/10.1001/jama.291.14.1753
- Frontera JA. Delirium and sedation in the ICU. neurocritical care. 2011 Jun 1;14(3):463–74.
- Sanders RD, Maze M. Contribution of sedative-hypnotic agents to delirium via modulation of the sleep pathway. Canadian Journal of Anesthesia/Journal canadien d’anesth sie [Internet]. Springer Science and Business Media LLC; 2010 Dec 18;58(2):149–56. Available from: https://doi.org/10.1007/s12630–010–9421–2
- Borbely AA, Achermann P. Ultradian dynamics of sleep after a single dose of benzodiazepine hypnotics. European Journal of Pharmacology [Internet]. Elsevier BV; 1991 Mar;195(1):11–8. Available from: https://doi.org/10.1016/0014–2999(91)90376–2
- Huupponen E, Maksimow A, Lapinlampi P, S rkel M, Saastamoinen A, Snapir A, et al. Electroencephalogram spindle activity during dexmedetomidine sedation and physiological sleep. Acta Anaesthesiologica Scandinavica [Internet]. Wiley; 2008 Feb;52(2):289–94. Available from: https://doi.org/10.1111/j.1399–6576.2007.01537.x
- Riker RR. Dexmedetomidine vs Midazolam for Sedation of Critically Ill Patients A Randomized Trial, JAMA [Internet]. American Medical Association (AMA); 2009 Feb 4;301(5):489. Available from: https://doi. org/10.1001/jama.2009.56
- Yuen VM, Hui TW, Irwin MG, Yuen MK. A Comparison of Intranasal Dexmedetomidine and Oral Midazolam for Premedication in Pediatric Anesthesia: A Double-Blinded Randomized Controlled Trial. Anesthesia & Analgesia [Internet]. Ovid Technologies (Wolters Kluwer Health); 2008 Jun;106(6):1715–21. Available from: https://doi.org/10.1213/ ane.0b013e 31816c8929
- Venn RM, Hell J, Grounds RM. Respiratory effects of dexmedetomidine in the surgical patient requiring intensive care. Critical Care. 2000 Oct;4(5):302–308.