Антисептичний розчин для профілактики і лікування пошкоджень та запальних процесів шкіри
Мета роботи. Дослідити алергічні, подразнюючі та наявність болю при використанні декаметоксину при дії на шкіру.
Матеріал та методи дослідження. У дослідження включено 75 пацієнтів з поверхневими пошкодженнями шкіри у 23 (30,66%) та гнійно-запальними недугами шкіри та підшкірної клітковини у 52 (69,34%) хворих дітей.
Результати дослідження. Хворі розподілені на дві групи. До І групи включено 23 (30,66%) пацієнтів, що мали поверхневі (інфіковані) пошкодження шкіри – амбулаторні хворі. До ІІ групи включено 52 (69,34%) хворих які лікувались стаціонарно. Рановий процес у всіх хворих не мав набряку та почервоніння – відсутність алергічної реакції на складові розчину.
Дослідження за шкалою інтенсивності болю за Wong-Baker, та десятибальною шкалу встановлено у 63 (90,0%) хворих старшого віку після не мали скарг під час проведення промивання рани. Натомість у 5 (7,14%) до 5 років та у 2 (2,86%) 8 років, встановлено відчуття страху перед процедурою.
Висновки. Дослідженнями не встановлено побічної дії як з боку рани, ранового каналу та навколишньої шкіри з відсутністю загальної алергії на декаметоксин. За шкалою інтенсивності болю Wong-Baker – використання розчину є безболісним на всіх етапах проведення лікування.
Ключові слова: поверхневе пошкодження шкіри, шкала інтенсивності болю, гнійно- запальне захворювання шкіри та підшкірної клітковини, розчин декаметоксину.
Вступ
Останні роки охарактеризувалися прогресуючим ростом резистентності штаммів грамнегативної і грампозитивної флори практично до усіх класів антибактеріальних препаратів. Гнійно-запальні захворювання та їх ускладнення складають, за різними джерелами, від 30 до 40% у структурі хірургічної патології [1, 21].
Провідне місце серед хірургічних інфекцій, як за частотою розвитку, так і за можливими ускладненнями займають гнійні захворювання шкіри та м’якими тканин [13, 17]. Однак до теперішнього часу хірургічні інфекції шкіри та м’яких тканин (ІШМТ), залишаються тією частиною хірургії, якій приділяється недостатня увага як лікарями поліклінічної служби, так і у стаціонарних відділеннях.
Епідеміологічна ситуація зараз характеризується зсувом етіологічної структури інфекційних захворювань у бік тих, що викликаються опортуністичними умовнопатогенними мікроорганізмами.
У структурі нозокоміальних інфекцій частота хірургічних інфекцій м’яких тканин (післяопераційне нагноєння та ін.) досягають від 24% до 36% [1]. Натомість інфекції, що впливають на м’яку тканину з розвитком осередка запалення, займають третє місце за частотою в етіологічній структурі сепсису, а в структурі лікарняних інфекцій ІШМТ істотно збільшують тривалість післяопераційного стаціонарного лікування, а як наслідок збільшені фінансові витрати [1].
На сьогодні значимість проблеми ІШМТ підкреслюється тим, що в структурі первинного звернення до загального хірурга їх частота досягає близько 70%. За даними літератури інфекції, пов’язані з шкірою та м’якими тканинами – найчастіша причина звернення пацієнтів за хірургічною допомогою, із яких у Великобританії до 10% всіх госпіталізацій, у Росії до 38,67%, у США у кількісному відношення до 330 000 госпіталізацій на рік, а у Росії близько 2 мільйонів хворих на рік [1, 17, 21].
Доцільно також акцентувати, що значна частка пацієнтів до 75%, із захворюваннями даного профілю, це хворі працездатного віку. В доповненні слід вказати, що середні терміни не виходу на роботу при амбулаторному лікуванні коливаються від 13,6 до 17,6 діб, а при стаціонарному лікуванні – від 18,5 до 23,8 діб [1, 12].
За даними Гельфанд Б. Р. та спів. (2015) щорічно в стаціонари Москви госпіталізуються понад 30 тис. пацієнтів з гострими захворюваннями м’яких тканин (ГЗМТ) і їх ускладненнями, а в екстреному порядку надходять 77% хворих. За тими ж даними при цій недузі загальна летальність коливається від 4,7 до 5%.
Тоді як летальність при таких захворюваннях, як некротичні інфекції, досягає 50%. В середньому оперативна активність при гнійних захворюваннях шкіри і м’яких тканин становить 88,8% [14, 15, 16]. За експертними оцінками, щорічно в РФ нозокоміальна інфекція виникає у 2,5 мільйона пацієнтів, з них у 24% – хірургічні інфекції шкіри і м’яких тканин [1, 15, 16, 18, 19].
Поміж тим на сьогодні оцінити справжню поширеність інфекцій шкіри і м’яких тканин вкрай складно. З одного боку, в цю групу входять позалікарняних інфекції, що розвиваються в результаті мікро- і макротравм, а з іншого – різноманітні інфекції області хірургічного втручання як асоційовані з покривами тіла, так і органні / порожнинні, але які дренуються через оперативний розріз [14, 20, 22].
Згідно з даними зарубіжних авторів, розвиток ускладнень на тлі ІШМТ призводить до продовження термінів стаціонарного лікування хворих у середньому на 10 діб. За даними Земляной А.Б. та співав. (2011) розвиток інфекційних ускладнень в ділянці хірургічного втручання призводить до продовження термінів лікування у стаціонарі в середньому на 16,7 діб, при виконанні планових операцій, на 9,2 діб – при виконанні абдомінальних операцій та на 6,9 судів – при всіх екстренних операцій [4].
Доцільно акцентувати, що в зв’язку з сучасною тенденцією до ранньої виписки хворих із стаціонару частина післяопераційних раневих ускладнень розвивається вже на амбулаторному етапі, що практично не вчиться під час аналізу ситуацій у Росії. За даними європейських дослідників [18, 19], в результаті ранньої виписки хворих із стаціонару, нагноєння післяопераційної рани розвивались на амбулаторному рівні, з частотою від 12 до 84% у залежності від типу операцій, а післяопераційна летальність підвищувалася з 2 до 5% [1, 18, 19, 15, 16].
Поміж тим за зведеними даними середня вартість лікування при нагноєнні післяопераційної рани в Європі становить 2000 євро [18]. При цьому в ці цифри не входять соціально-економічні витрати, пов’язані з відсутністю працівників на роботі.
Таким чином на сьогодні набуває значення місцеве медикаментозне лікування пошкоджень шкіри на початку отримання травми, а не після ускладнень, що і вважається одним із важливих компонентів лікування інфекцій м’яких тканин [1, 3, 7, 8, 9].
Мета роботи
Дослідити алергічні та подразнюючі властивості декаметоксину у лікарському засобі Горостен® у дітей при лікуванні гнійно-запальних недуг шкіри та профілактиці нагноєння при поверхневих травматичних пошкодженнях шкіри.
Матеріал та методи дослідження
У дослідження було включено 75 пацієнтів з поверхневими пошкодженнями шкіри у 23 (30,66%) та гнійно-запальними захворюваннями шкіри та підшкірної клітковини у 52 (69,34%) хворих дітей. Вік хворих склав від 1 до 18 років. Принципової відмінності у хворих за статтю не встановлено.
Для виділення та дослідження біологічних властивостей мікрофлори виконували забір матеріалу з рани стерильною серветкою, з подальшим культивуванням на селективних середовищах та ідентифікацією мікроорганізмів стандартними мікробіологічними методами. У 52 (69,34%) хворих ІІ групи одночасно проводилося клініко-лабораторне дослідження крові та сечі.
У всіх хворих використовували Горостен® як для профілактики так і лікування гнійно- запальних недуг. Дослідження виконали відповідно до принципів Гельсінської декларації. Протокол дослідження ухвалили Локальним етичним комітетом зазначених установ. На проведення досліджень отримали інформовану згоду (батьків) пацієнтів .
Результати дослідження
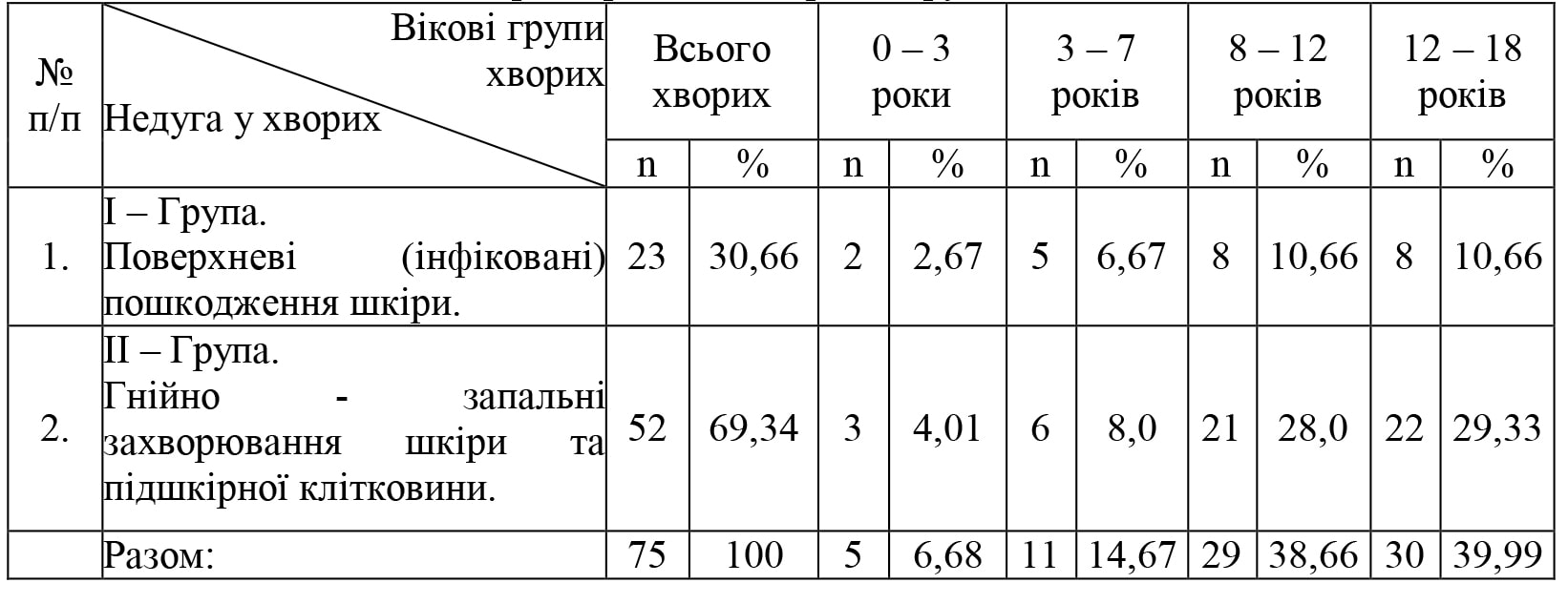
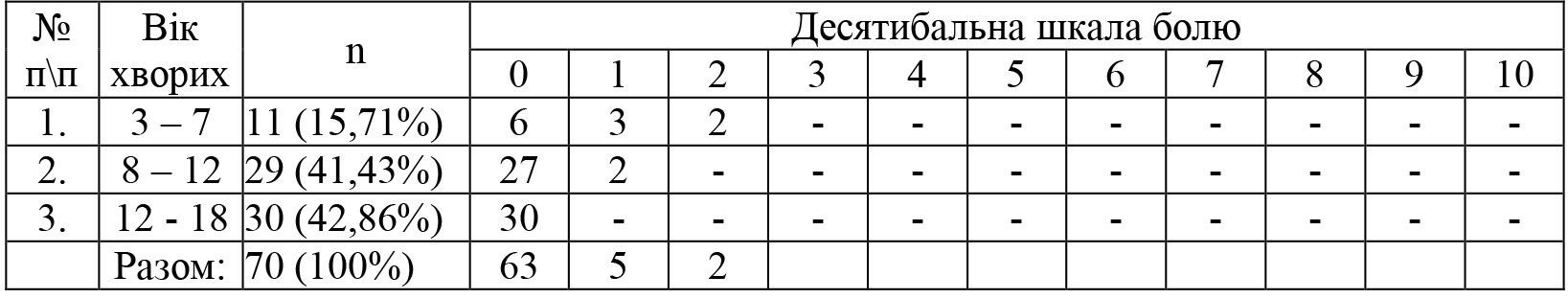
Виходячи з клінічного матеріалу хворі розподілені на дві групи. Вікова характеристика хворих в групах дослідження представлена в таблиці 1. Доцільно вказати, що дітей до 3 років було 5 (6,68%), від 3 до 7 років 11 (14,67 %), від 8 до 12 років 29 (38,66 %), а від 12 до 18 років 30 (39,99 %).
Таблиця 1. Вікова характеристика хворих в групах дослідження
 До І групи, це амбулаторні хворі включено 23 (30,66%) пацієнтів, що мали поверхневі (інфіковані) пошкодження шкіри, із яких на верхніх кінцівках у 9 (12,0%) та нижніх кінцівках у 14 (18,66%). Забір матеріалу (посів вмісту рани) проводився відразу, а потім ранову поверхню рясно зрошували розчином Горостен® з метою механічного очищення рани, а в подальшому просушування під потоком повітря.
До І групи, це амбулаторні хворі включено 23 (30,66%) пацієнтів, що мали поверхневі (інфіковані) пошкодження шкіри, із яких на верхніх кінцівках у 9 (12,0%) та нижніх кінцівках у 14 (18,66%). Забір матеріалу (посів вмісту рани) проводився відразу, а потім ранову поверхню рясно зрошували розчином Горостен® з метою механічного очищення рани, а в подальшому просушування під потоком повітря.
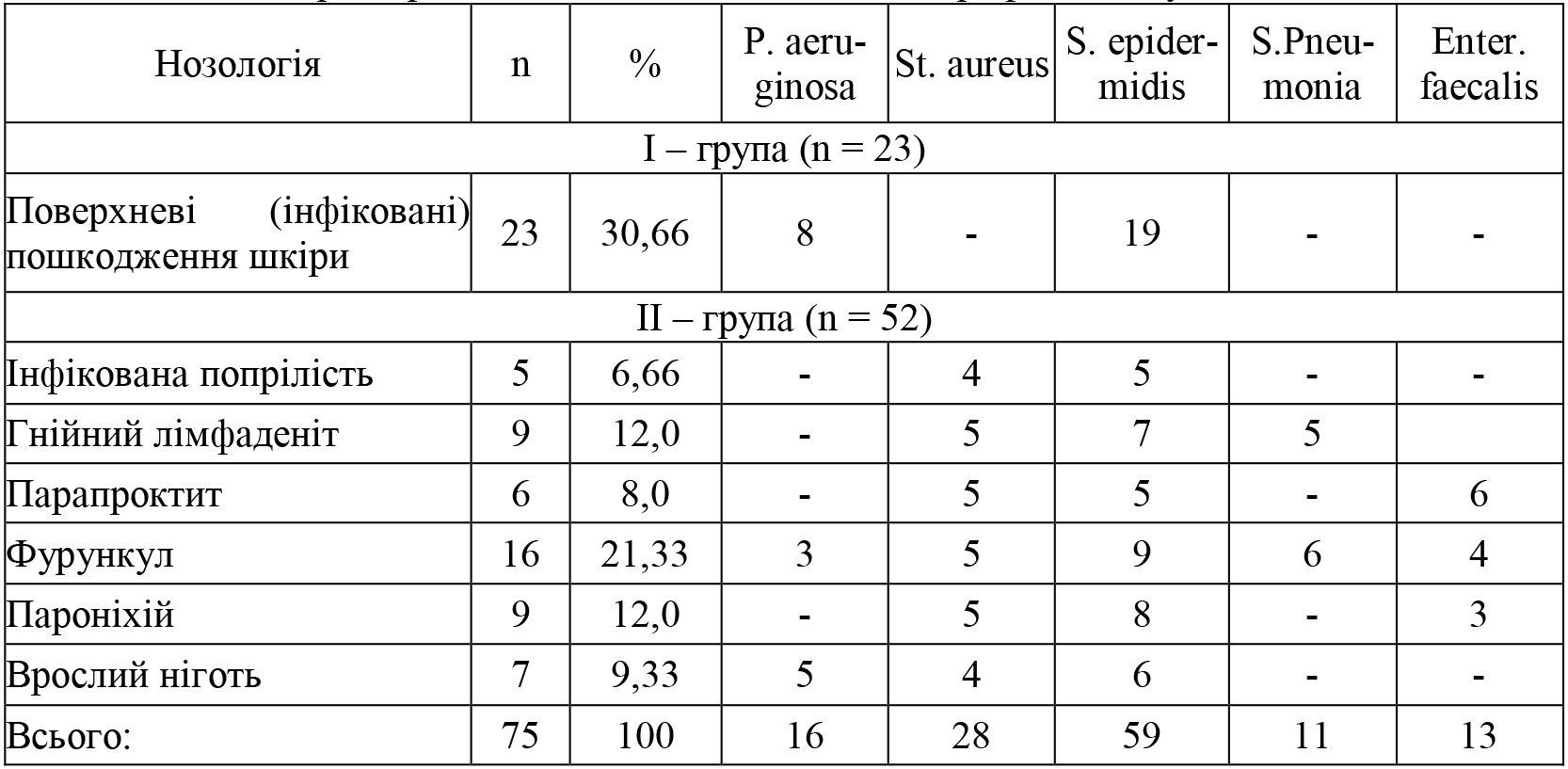
У 11 (14,67%) пацієнтів повторно проведено забір матеріалу після обробки розчином Горостен®. Мікробіологічна характеристика збудників гнійно-запального процесу представлена в таблиці 2. За результатами мікробіологічного дослідження у 75 пацієнтів встановлено 127 збудника, із яких у 52 більше одного збудника (69,33%). Так в першій групі з 23 (30,66%) пацієнтів у 8 (10,66%) встановлено два збудника (P. Aeruginosa + S. epidermidis), а у 15 (20,0%%) один (S. epidermidis).
В ІІ групі дослідження у 52 (69,34%) пацієнтів висіяно 100 збудників, із яких тільки у одного один збудник, а в 51 (68,0%) більше 2 збудників.
При пристальному спостереженні за процедурою очищення рани визначали наступні дані як з боку рани так і загального стану дитини: набряк почервоніння – локальне та наявність алергічної реакції. Замір загальної температури проводився у всіх 23 (30,66%) хворих – без змін.
Власні дослідження показали, що всі хворі І групи не мали локальної та загальної алергійної реакції. Рана не мала набряку, гіперемії, а також не відчували діти дискомфорту при обробці рани – рясному зрошуванні розчином Горостен®. Моніторинг за формуванням та відходженням кірочки показав, що ні в одному випадку під кірочкою не утворювався серозний чи гнійний вміст.
Дані моніторингу вказують на дієвість антисептичного розчину відносно патогенної флори яка була встановлена при первинному посіві. У 8 (10,66%) дітей у віці до 8 років було відчуття страху при проведенні зрошування рани. Подальші зрошування розчином Горостен® проводилися до відходження кірочки.
До ІІ групи включено 52 (69,34%) пацієнти з нозологічною характеристикою недуги, що представлена в таблиці. Поміж тим всім хворим другої групи проводилася ідентифікація збудника та чутливість до антибіотиків. Результати клініко-лабораторного дослідження крові показали, що мав місце лейкоцитоз 9-11Ч109, а також зрушення формули вліво п-я від 7-8 до 12-15 в полі зору, при незмінних вікових даних еозинофілів 0-1-2 в полі зору.
Зважаючи на те, що хворі отримували комплексне лікування проводили зрошування ранової поверхні розчином Горостен®. При зрошенні та очищенні рани від гнійного та серозного вмісту визначали наступні дані з боку рани: набряк та локальне почервоніння, а також загальний стан дитини на наявність алергічної реакції.
Таким чином моніторинг ранового процесу у всіх хворих не мав набряку та почервоніння як самої рани так і навколишніх тканин, що свідчить про відсутність алергічної реакції на складові розчину Горостен®. Найбільш показовий ефект при завершенні лікування при відсутності загальних лікарських засобів коли утворюється кірка над раною без ознак утворення серозного чи гнійного вмісту під нею.
Таблиця 2. Характеристика нозології пацієнтів та верифікація збудників
 Наступним етапом у контексті нашого дослідження було вивчення інтенсивності болю при використанні Горостен® при обробці пошкоджень чи ранових утворень. Поміж тим ми припустили, що переживання болю дітьми та підлітками залежить від віку та рівня їхньої особистісної та ситуативної тривожності, що спричиняє зрештою і психологічний дискомфорт.
Наступним етапом у контексті нашого дослідження було вивчення інтенсивності болю при використанні Горостен® при обробці пошкоджень чи ранових утворень. Поміж тим ми припустили, що переживання болю дітьми та підлітками залежить від віку та рівня їхньої особистісної та ситуативної тривожності, що спричиняє зрештою і психологічний дискомфорт.
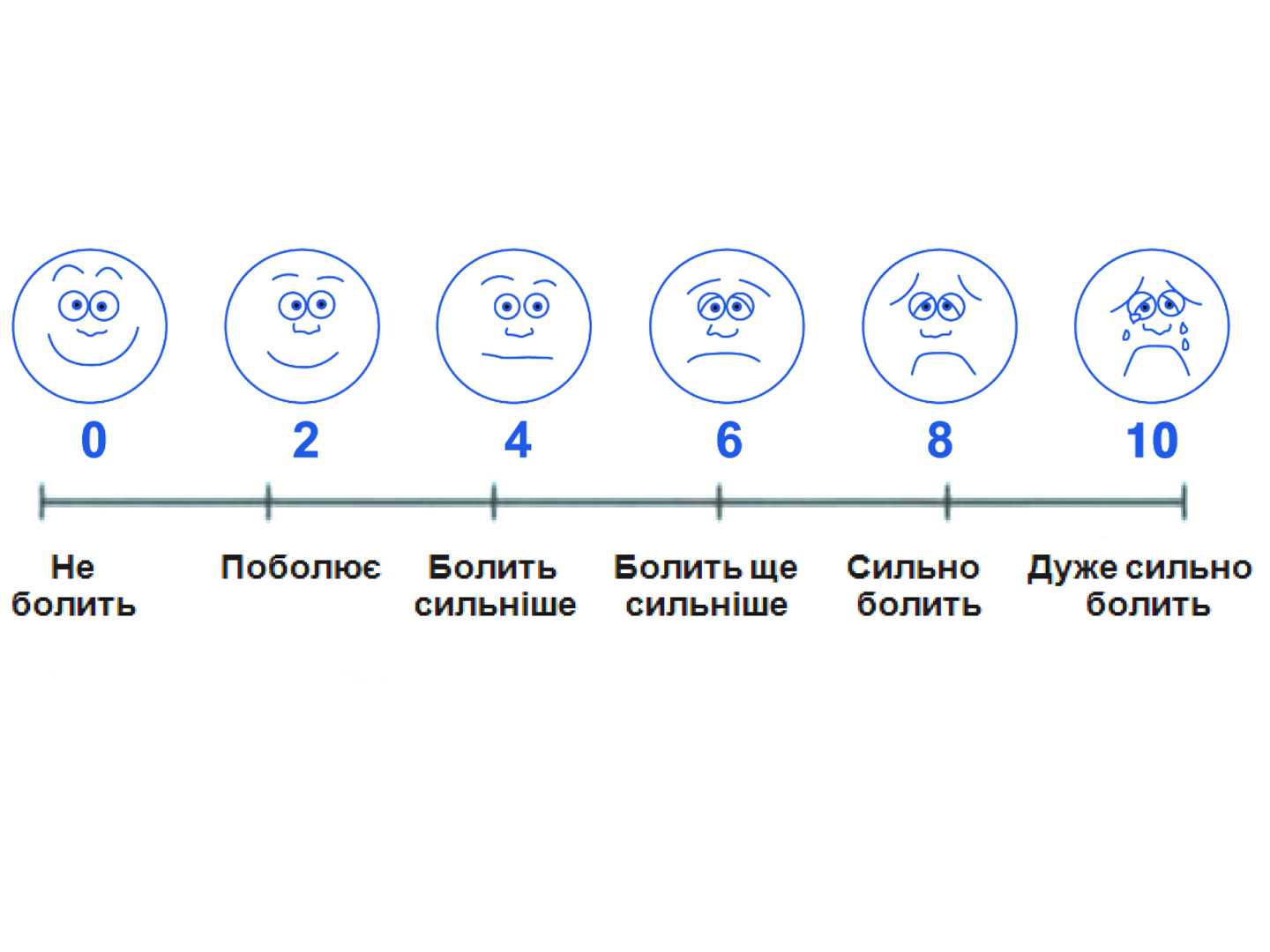
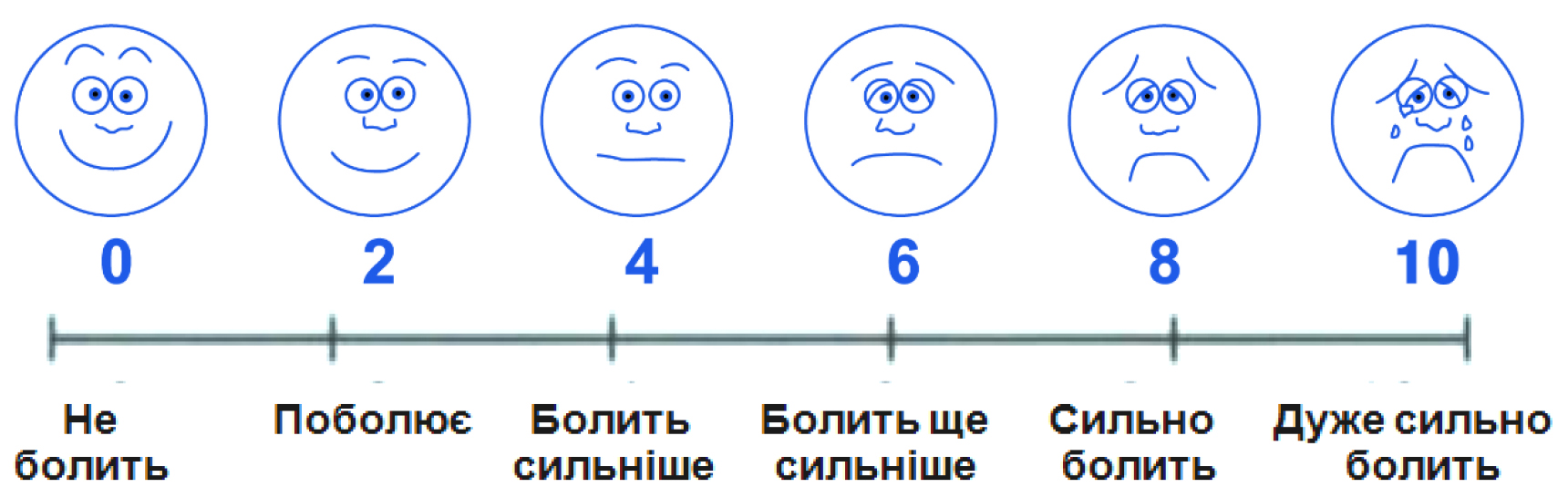
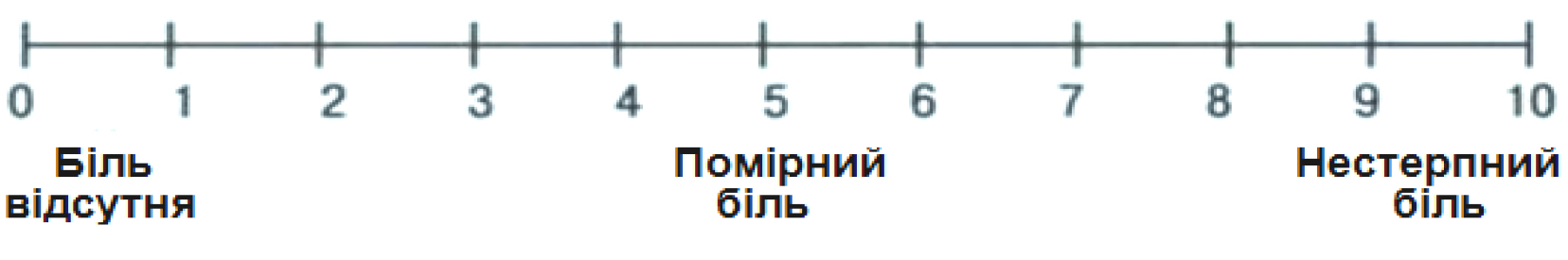
З огляду на це, для суб’єктивної оцінки інтенсивності болю застосовувалася шкала Wong-Baker Faces (1983) в україномовній адаптації для дітей віком від 3 до 8 років (рисунок 1), та 10-бальнаа шкала інтенсивності болю (рисунок 2). Результати власного дослідження представлені в таблиці 3.
Рисунок 1. Візуалізаційна шкала за Wong-Baker FACES® інтенсивності болі за станом обличчя
 Зазвичай у дітей, а у більш раннього віку більш виражена тривожність, яка діагностувалася за допомогою «Тесту тривожності Р. Теммл, М. Доркі, В. Амен» (для дітей до 8 років) та «Шкали тривоги Спілбергера», в адаптації Ю. Ханіна (для осіб віком від 9 до 17 років). Зрозумілим є те, що ми розрізняємо у дітей тривожність як властивість особистості (особиста тривожність) так і тривогу як стан.
Зазвичай у дітей, а у більш раннього віку більш виражена тривожність, яка діагностувалася за допомогою «Тесту тривожності Р. Теммл, М. Доркі, В. Амен» (для дітей до 8 років) та «Шкали тривоги Спілбергера», в адаптації Ю. Ханіна (для осіб віком від 9 до 17 років). Зрозумілим є те, що ми розрізняємо у дітей тривожність як властивість особистості (особиста тривожність) так і тривогу як стан.
Таким чином оцінка особистісної тривожності інформує про схильність хворої дитини до тривоги, тоді як стан тривоги характеризують суб’єктивно пережиті емоції напруження, занепокоєння та стурбованістю напередодні обробки травматичної рани чи осередку запалення. Тому вважаємо за доцільне перед проведення обробки чи перев’язки побризгати на руку, щоб дитина переконалася, що не пече та не подразнює.
Дослідженнями встановлено, що у пацієнтів із високим рівнем тривожності діагностовано низький рівень больових відчуттів (табл. 3). Поміж тим дещо вищі вони у хворих дітей та підлітків із низькою та помірною тривожністю. Власне проведений кореляційний аналіз засвідчив обернену залежність у хворих дітей, між цими змінними: чим вищою була тривожність, тим нижчий був поріг больової чутливості, і навпаки.
Сутність десятибальної шкали полягає у дослідження як виразу обличчя, так і вивчення інтенсивності болі за 10 бальною шкалою, що схематично представлено на рисунку 2.
Рисунок 2. Десятибальна шкала інтенсивності болю
 Так у 5 (7,14%) пацієнтів у віці 5 років оцінка болю (болить) була пов’язана зі страхом про проведення маніпуляції очистки рани. Також у 2 (2,86%) 8 річних пацієнтів відчуття страху було на початку промивання рани (пошкодження), а під час проведення та на закінчення обробки рани реакція на біль відсутня.
Так у 5 (7,14%) пацієнтів у віці 5 років оцінка болю (болить) була пов’язана зі страхом про проведення маніпуляції очистки рани. Також у 2 (2,86%) 8 річних пацієнтів відчуття страху було на початку промивання рани (пошкодження), а під час проведення та на закінчення обробки рани реакція на біль відсутня.
Поміж тим 63 (90,0%) хворих старшого віку після 7 років не скаржилися на печію в рані чи на шкірі під час проведення промивання рани.
Таблиця 3. Оцінка результатів за візуалізаційною 10 бальною шкалою інтенсивності болю
 Таким чином, обробка як ранових пошкоджень так і при лікуванні осередків гнійно- запального процесу (фурункул, врослий ніготь, парапроктит та інші недуги) розчином срей Горостен® за візуалізаційною шкалою інтенсивності болю (від 0 до 10) має інтенсивність болю – 0, що дозволяє проводити повноцінну обробку ран та пошкоджень від початку отримання рани.
Таким чином, обробка як ранових пошкоджень так і при лікуванні осередків гнійно- запального процесу (фурункул, врослий ніготь, парапроктит та інші недуги) розчином срей Горостен® за візуалізаційною шкалою інтенсивності болю (від 0 до 10) має інтенсивність болю – 0, що дозволяє проводити повноцінну обробку ран та пошкоджень від початку отримання рани.
Натомість у 7 пацієнтів, що складає 10,0% більше був страх перед початком використання так як хворі були у віці 5 рокі, а на фінішній обробці ранового пошкодження не звертали увагу на обробку.
Обговорення
Питання ефективності використання розчину Горостен® для санації та лікування інфікованих та гнійних ран представлено на шпальтах медичних видань. Про те в цих роботах відсутні дані про дані про наявність чи відсутність місцевої негативної дії: набряк рани, почервоніння, печію в рані, а також алергічні прояви як місцевого так і загального характеру.
Вивчення лікувальних властивостей горостену при лікуванні гнійних ран провели Ковальчук В.П. та співавтори (2006) з порівнянням ефективності з антисептичними препаратами для місцевого лікування гнійної рани: 0,05% розчином хлоргексидину біглюконату, 0,02% розчином етонію, фурациліном (1:5000) і 10% розчином хлориду натрію.
Клінічну ефективність місцевого застосування розчинів цих антисептиків вивчали у 444 хворих з гнійними ранами різного походження. Критеріями оцінки ефективності лікувальної дії антисептичних препаратів були терміни очищення ран від гнійно- некротичного вмісту, поява грануляцій і початок епітелізації [5].
Наступними дослідженнями Кондратюк В.М. та спіавтори (2012) вивчали препарати Горостен та Амосепт на основі декаметоксину для антисептичної обробки шкіри хворих перед постановкою та при догляді за внутрішньосудинними катетерами.
Авторами за результатами бактеріологічного дослідження ступеня мікробної забрудненості шкіри навколо місця постановки катетера та результати посівів катетера свідчать про вищу профілактичну ефективність Амосепту і 0,1 % спиртового розчину декаметоксину, ніж йодвмісних антисептиків [6].
Натомість Гончар О.О. та співавт. (2016) за результатами вивчення антимікробних властивостей Декаметоксин® встановили, що Високі антимікробні властивості препаратів генеричної субстанції декаметоксину® обґрунтовують їх застосування для профілактики, лікування інфекційних ускладнень, спричинених кишковою паличкою, а також в боротьбі з кандидозною інфекцією, та інфекцією, спричинененою антибіотикорезистентними штамами S. aureus, E. coli, С. Albicans.
Дослідженнями встановлено відсутність відмінностей у антимікробній активності лікарських форм (горостен®, декасан®, септефрил), що містять діючу лікарську речовину генеричного декаметоксину® (р < 0,05) [2].
Фаустова М.О, Назарчук О.А. (2018) вивчали чинники імплантаційних ускладнень в щелепно лицьовій хірургії. Авторами встановлено, що грамнегативні неферментуючі збудники родів Pseudomonas spp. та Acinetobacter spp., що колонізують периімплантатну ділянку за умов ускладнень одонтоімплантації, володіють високими біоплівкоутворюючими властивостями.
Декасан в суббактеріостатичній концентрації пригнічує утворення біоплівок клінічними штамами P. aeruginosa протягом перших 24 год культивування. Клінічні ізоляти Р. aeruginosa, які знаходяться у сформованій біоплівковій формі, виявляють високу чутливість до суббактеріостатичних концентрацій антисептиків на основі декаметоксину (декасан, горостен).
Присутність антисептичних засобів не впливає на процес утворення біоплівок клінічними штамами A. baumannii. в першу добу культивування, проте суббактеріостатичні концентрації декасану, горостену та хлоргексидину суттєво пригнічують сформовані дводобові біоплівкові форми A. baumannii. [10, 11].
Заключення
Таким чином, підводячи підсумок дослідження, доцільно вказати, що нами доповнені ті позитивні результати проведених досліджень. Нами доповнено, що препарат не має патологічного впливу на рану та шкіру у вигляді набряку, почервоння та печії при обробці, а також відсутня алергічна реакція на препарат при його використанні у близькому та відділеному періоді.
Ймовірно настає час за результатами багатоцентрового дослідження про ефективность розчин Горостен® для місцевого застосування з метою профілактики нагноєння первинно інфікованих ран, а також в лікуванні гнійних ран як в умовах амбулаторії так і стаціонару.
Важливе питання при обробці пошкоджень чи ранових утворень це наявність болю, її інтенсивність, а також залежність міри вираження болю від психосоціального середовища, а тому за звичай постає питання про застосування психопрофілактичних і психотерапевтичних заходів для зниження рівня ситуаційної тривоги.
Тому на сьогодні одним із нефармакологічних способів зменшення больового синдрому є відволікання уваги дитини-пацієнта від негативних ситуацій при обробці, та її переключення на нейтральний чинник. За звичай цей спосіб є досить ефективним, якщо він адаптований до рівня розвитку дитини, а тому відволікання скорочує термін проведення процедури та кількість персоналу задіяного в наданні допомоги.
Таким чином, на завершення доцільно акцентувати, що профілактика болю є важливим елементом у лікуванні дітей різного віку. На сьогодні одним із нефармакологічних способів зменшення больового синдрому у дітей є відволікання уваги дитини від негативних ситуацій за допомогою когнітивних, поведінкових або комбінованих складових, що дозволяє в цілому досягти результату.
Висновки:
- Розчин Горостен® має високу профілактичну і лікувальну ефективність, при відсутності побічної дії як з боку рани та ранового каналу так і навколишньої шкіри (набряк, гіперемія та печія) з відсутністю алергії на препарат.
- Перевагою розчину Горостен® є висока бактеріологічна ефективність у порівнянні з традиційними гігієнічними засобами, а також його пом’якшувальні властивості плину на шкіру при його тривалому використанні, не викликає сухості та поява тріщин на руках.
- За візуалізаційною шкалою інтенсивності болю (за Wong-Baker FACES®) використання розчину Горостен® є безболісним на всіх етапах обробки як пошкодженої рани так і гнійно-запальної.
Автори:
В. Ф. Рибальченко1,2, М. О. Талько3, Р. М. Борис2, В. В. Кравченко3, І. В. Лишевська3, Н. В. Науменко3
1 Національний університет охорони здоров’я України імені П.Л.Шупика;
2 «ПВНЗ» Київський медичний університет;
3 КНП «Київська міська дитяча клінічна лікарня №1».
Автори заявляють про відсутність конфлікту інтересів.
Література:
- Гельфанд Б. Р. Хирургические инфекции кожи и мягких тканей: Рос. нац. рекомендации.- 2-ое переработ. и доп. издание. – М.: Рос. об-во хирургов, 2015. – 109 с.
- Гончар О.О., Назарчук О. А., Палій Д. В., Коваленко І. В., Яцула О. В. Вивчення антимікробних властивостей лікарських антисептичних препаратів, що містять Декаметоксин®. Український біофармацевтичний журнал, № 1 (42) 2016. С. 74 – 77.
- Декаметоксин, порошок (субстанція). Державний реєстр лікарських засобів МОЗ України. Реєстраційне посвідчення на лікарський засіб № UA/12128/01/01. Наказ МОЗ України від 13.04.2012 № 264.
- Земляной А. Б., Юсупов И. А., Кисляков В. А. Состояние цитокиновой системы при гнойно-некротических и рецидивирующих гнойно-некротических осложнениях синдрома диабетической стопы и возможности иммуномодуляции. Трудный пациент. 2011; 10: 36-43.
- Ковальчук В. П., Палій В. Г., Грабік І. М. Характеристика профілактичної і лікувальної ефективності нового вітчизняного антисептичного препарату Горостен. Нова медицина: журнал для лікарів та медичної громадськості. – 2006. N 1, c.72 -75
- Кондратюк В.М., Трофіменко Ю.Ю., Кондратюк О.П., Патик В.В., Гарчук П.П., Гончаров О.Л., Корсун А.В., Кобзіна Л.В., Олійник В.М., Педоренко Л.В., Подолян Т.М. Антисептичні розчини на основі декаметоксину в порівнянні з повідонйодом для профілактичної обробки шкіри при догляді за венозними катетерами. Український хіміотерапевтичний журнал 2012 № 3 (27), с. 56 – 59.
- Рибальченко В.Ф., Степанова Н.В., Науменко Н.В., Коваленко Б.В., Кравченко В.В., Лишевська І.В., Радзіховський О.В. Мікробіологічна характеристика збудників пневмонії у новонароджених дітей та їх чутливість до антибактеріальних препаратів. Збірник наукових праць За матеріалами науково-практичної конференції «Інноваційні технології в хірургії та анестезіології і інтенсивній терапії дитячого віку». 18-19 жовтня 2019 року. м.Київ. с. 71-73.
- Рибальченко В.Ф., Н.В. Степанова, Н.В. Науменко, Б.В. Коваленко, В.В. Кравченко, І.В. Лишевська, О.В Радзіховський. Мікробіологічна характеристика збудників пневмонії у новонароджених дітей та їх чутливість до антибактеріальних препаратів. // Хірургія дитячого віку № 3 (60) / 2018 с. 115-116.
- Светухин А.М., Цветков В.О., Земляной А.Б., Молчанов В.В. Нерешенные проблемы диагностики и лечения тяжелой анаэробной инфекции мягких тканей. В кн.
- «Неотложная медицина в мегаполисе. Материалы второго международного форума. Москва, 20-21 апреля 2006» С. 130-131.
- Фаустова M. O. Етіологічна структура, біологічні властивості домінуючих збудників периімплантатного мукозиту / M. O. Фаустова, О. А. Назарчук, M. M. Ананьєва // Запорожский медицинский журнал. — 2017. — Т. 19, № 5 (104). — С. 652—657.
- Фаустова М.О. Вплив сучасних антисептичних засобів на формування біоплівок грамнегативними збудниками інфекційно-запальних імплантаційних ускладнень / М.О. Фаустова, О.А. Назарчук // Актуал. пробл. сучасн. мед.: Вісн. Укр. мед. стомат. акад.: науковопрактичний журнал. – 2018. – Т. 18, № 1 (61). – С. 200-204.
- Шляпников С.А. Хирургические инфекции мягких тканей – старая проблема в новом свете. Инфекции в хирургии. 2003; 1 (1): 14-21.
- DiNubile M.J., Lipsky B.A. Complicated infections of skin and skin structure infections: When infection is more than skin deep. J Antimicrob Chemother. 2004; 53: 37-50.
- Drusano G.L. Early endpoints for acute bacterial skin and skin structure infections. Antimicrob Agents Chemotherapy. 2012; 56(5): 2221-2222.
- Edelberg J., Berger A., Weber D.J. et al. Clinical and economic consequences of failure of initial antibiotic therapy for hospitalized patients with complicated skin and skin structure infections. Infect Control Hosp Epidemiol. 2008; 29: 160-169.
- Edelberg J., Taneja C., Zervos M. et al Trends in US hospital admissions for skin and soft tissue infections. Emerg Infect Dis. 2009; 14: 1516-1518.
- Kozlov R.S., Krechikova O.I., Ivanchik N.V. et al. Etiology of Nosocomial Bacterial Infections in Russia. Rosnet Study Group. Proceedings of the 48th Interscience Conference on Antimicrobial Agents and Chemotherapy; 2008 Oct 25-28; Washington, DC, USA; p. 572, abst. K-4108.
- Leaper D., JMcBrain A., Kramer A.et al Healthcare associated infection: novel strategies and antimicrobial implants to prevent surgical site infections. Review Ann R Coll Surg Engl. 2010; 92.
- Leaper D., Noy B. Surgical site infection – a European perspective of incidence and economic burden. Int Wound J. 2004; 1: 247-273.
- Marwick C., Broomhall J., McCowan C. et al. Severity assessment of skin and soft tissue infections: cohort study of management and outcomes for hospitalized patients. J Antimicrob Chemother. 2011; 66: 387-397.
- Pulgar S., Mehra M., Quintana A. et al. The epidemiology of hospitalized cases of skin and soft tissue infection in Europe. 18th European Congress of Clinical Microbiology and Infectious Diseases. Barcelona, Spain, 2008. Abstr. P821.
- Zervos M.J., Freeman K., Vo L. et al. Epidemiology and outcomes of complicated skin and sift tissue infections in hospitalized patients. J Clin Microbiol. 2012; 50: 238-245.



