Метаболічна регуляція в мітохондріях як перспективний шлях омолодження організму
Вчені всього світу шукають засоби для досягнення якісного й активного довголіття. Складність цих пошуків пов’язана з відсутністю єдиної концепції механізмів старіння, проблемою екстраполяції результатів досліджень геропротекторів із модельних організмів на людей. Тому сучасна медицина може поки що лише сповільнити процес старіння. Утім доведено, що порушення в роботі мітохондрій є важливою ланкою патогенезу старіння, тому регуляція їх метаболізму є перспективним шляхом омолодження організму.
Зменшення синтезу білків і загальне зниження інтенсивності дії окисних ферментів є взаємопов’язаними. Зі зниженням інтенсивності окисних процесів зменшується виробництво енергії, необхідної для синтезу білка і ДНК. Із віком також розвивається дисфункція мітохондріальних пристосувальних реакцій, що може бути пов’язано з низькою ефективністю роботи НАДН- дегідрогеназного комплексу – НАДН-убіхінон-оксидоредуктази, який каталізує перенесення електронів від НАДН до убіхінону/коензиму Q10, результатом чого є зниження транспорту електронів і збільшення кількості активних форм кисню. Зниження рівня коензиму Q10 відіграє дуже важливу роль у процесах старіння, оскільки він є антиоксидантом і на відміну від інших антиоксидантів виробляється в організмі. Підвищення біогенезу мітохондрій, а також збільшення швидкості й ефективності мітохондріального метаболізму, як, наприклад, при дієті з обмеженням калорій, сприяє покращенню енергозабезпечення клітин та подовженню життя.
Засіб на основі ксилітолу Ксилат шляхом метаболізму через пентозофосфатний цикл може бути джерелом тригліцерофосфату й тим самим зменшувати кількість вільних жирних кислот, здатних окислюватися в ацетил-КоА, сприяє підвищенню в печінці вмісту аденозинтрифосфорної кислоти та інших аденілнуклеотидів, чинить виражену антикетогенну дію. Його застосування дозволяє зменшити iнтоксикацiю й покращити мікроциркуляцію, що особливо важливо для якісного і активного довголіття. Активація метаболізму мітохондрій є перспективним напрямком профілактики старіння, оскільки дає змогу збалансувати обмінні процеси не лише у клітинах, а й в організмі в цілому.
Ключові слова: мітохондріальна дисфункція, старіння, омолодження організму, ксилітол, Ксилат.
Для старіючого організму характерне зниження інтенсивності пластичного обміну на фоні зниження інтенсивності загального обміну речовин, уповільнення самооновлення білків. Це призводить до зменшення швидкості поділу клітин і порушення їх регенерації. Якщо у 20‑30 річної людини середня вага всіх м’язів складає 36 кг, то у 70‑80 річної через атрофію м’язової тканини вона набагато нижча – 23‑24 кг. Зменшується також вміст білків і кількість нервових клітин у корі головного мозку, а кількість ліпоїдів збільшується. Через уповільнення розмноження та загибель клітин кісток відбувається їх розрідження й зменшення міцності (старечий остеопороз). Сповільнюється синтез еритроцитів, погіршується загоєння ран.
Іншою важливою особливістю старіючого організму є зниження інтенсивності окисних процесів. У стані спокою споживання кисню у 70річної людини становить 60% від кількості кисню, споживаного 20‑30річною (у розрахунку на 1 кг маси тіла).
Зменшення синтезу білків і загальне зниження інтенсивності дії окисних ферментів є взаємопов’язаними. Оскільки останні є білками, то сповільнюється й їх синтез, що призводить до зниження інтенсивності процесів біологічного окислення. З іншого боку, зі зниженням інтенсивності окисних процесів зменшується виробництво енергії, необхідної для синтезу білка і ДНК.
На рівні клітин старіння проявляється такими порушеннями, як:
• пошкодження ДНК;
• дисфункція мітохондрій, що призводить до збільшення утворення активних форм кисню (АФК) і зниження виробництва аденозин‑3фосфату (АТФ);
• окисне пошкодження білків та інших макромолекул;
• неналежне згортання білків та їх агрегація;
• глікірування білків;
• активація синтезу прозапальних цитокінів;
• вкорочення теломер;
• припинення клітинного поділу;
• різке скорочення популяції стовбурових клітин.
Роль мітохондрій у процесах старіння
Мітохондрії – це клітинні органели, основна функція яких полягає у виробництві енергії у вигляді молекули АТФ. Порушення енергетичного обміну розглядається як один з провідних патологічних процесів, що призводить до незворотних наслідків і загибелі організму.
Життєдіяльність організму з підтриманням усіх фізіологічних функцій і біохімічних процесів можлива лише за умови його постійного енергозабезпечення. Однак під дією деяких факторів синтез енергії порушується. Вікові зміни, вплив токсинів, ультрафіолетових променів, медикаментів, шкідливої їжі та стресу провокують утворення вільних радикалів і кінцевих продуктів глікозилювання (advanced glycation end products, AGE). AGE – це група гетерогенних молекул, які утворюються в результаті неферментативного глікозилювання (зв’язування з вуглеводами) білків, жирів і нуклеїнових кислот.
Ці сполуки не тільки надходять з їжею, а й також можуть утворюватися в організмі у результаті підвищення концентрації глюкози у крові або оксидативного стресу. Підвищення рівня AGE в організмі призводить до розвитку запалення у нервовій системі, до дистрофічних процесів у сітківці, до артеріальної гіпертензії, атеросклерозу, ішемічної хвороби серця, інсульту, анемії, хронічних захворювань нирок і ниркової недостатності, остеопорозу й переломів кісток, зниження маси м’язової тканини й сили м’язів, зниження еластичності шкіри та розвитку зморшок.
Вплив таких негативних факторів на роботу мітохондрій спричиняє клітинну мітохондріальну дисфункцію й прискорену загибель клітини внаслідок втрати нею своїх енергосинтетичних і детоксикаційних функцій. Це явище зумовлене розвитком гострого кисневого голодування тканин. Дефіцит кисню – акцептора електронів у мітохондріальному дихальному ланцюгу призводить до глибокого пригнічення біоенергетичної функції мітохондрій, що асоціюється з більш швидким укороченням довжини теломер і прискореним старінням клітин та організму в цілому.
Порушення у системі клітинного енергоутворення є важливим елементом патогенезу багатьох захворювань. На думку ряду авторів, підтримання життя в екстремальних умовах можливе до тих пір, поки дефіцит енергії не досягне критичних значень.
Виснаження клітинних енергетичних резервів нижче допустимого рівня супроводжується розвитком у клітині незворотних процесів і загибеллю організму. Тому для підтримання нормальної активності та життєдіяльності клітин необхідні спеціальні субстрати, такі як ксилітол (Ксилат), що впливають на метаболізм процесів енергоутворення.
Основні етапи катаболізму поживних речовин
Розщеплення складних поживних речовин на більш прості є необхідною умовою подальшого використання їх у клітині як джерела енергії та пластичного матеріалу. На рис. 1 представлений складний процес розщеплення поживних речовин, який забезпечує поступове вивільнення енергії й акумуляцію її у вигляді АТФ.
У катаболізмі основних поживних речовин (вуглеводів, білків і жирів) можна виділити три основні стадії:
• Перша стадія – великі молекули під впливом складних ферментативних систем розщеплюються на більш прості: вуглеводи – до гексоз і пентоз, ліпіди – до гліцерину і жирних кислот, а з білків утворюється близько двадцяти амінокислот.
• Друга стадія – подальше розщеплення утворених з’єднань. Із двадцяти різних амінокислот утворюється лише кілька кінцевих продуктів, а саме: ацетилкоензим А (ацетилКоА), αкетоглутарова і щавелевооцтова кислоти. Жирні кислоти у процесі βокислення перетворюються на ацетилКоА, а гексози розщеплюються до піровиноградної кислоти, яка потім у процесі окисного декарбоксилювання також перетворюється на ацетилКоА. Метаболіти, що утворилися на другій стадії розпаду поживних речовин (ацетилКоА, αкетоглутарова, щавелевооцтова кислоти), входять у третю стадію, яка для них є спільною і на якій вони в кінцевому підсумку окислюються до СО2 і Н2О.
• Третя стадія – термінальне окислення поживних речовин, у процесі якого вивільнюється основна маса енергії, здійснюється в мітохондріях через цикл трикарбонових кислот (ЦТК) і мітохондріальний дихальний ланцюг. ЦТК – загальний кінцевий шлях окисного катаболізму всіх видів клітинного «палива» в аеробних умовах. У цьому циклі під дією специфічних дегідрогеназ протікають процеси дегідрування субстратів, відновлювальні еквіваленти від яких (протони й електрони) надходять до мітохондріального дихального ланцюга. Дегідрування, а саме відщеплення молекул Н2 від інтермедіатів циклу Кребса, відбувається в основному за допомогою дегідрогеназ, простетичною групою яких є нікотинамідаденіндинуклеотид (НАД), і лише дегідрування бурштинової кислоти здійснюється флавінаденіндинуклеотидзалежною дегідрогеназою (сукцинатдегідрогеназою). Дихальний ланцюг – поліферментна система, локалізована на внутрішній мембрані мітохондрій, основними компонентами якої є НАДзалежні дегідрогенази, флавопротеїни і цитохроми (рис. 1), є фінальним етапом катаболізму поживних речовин.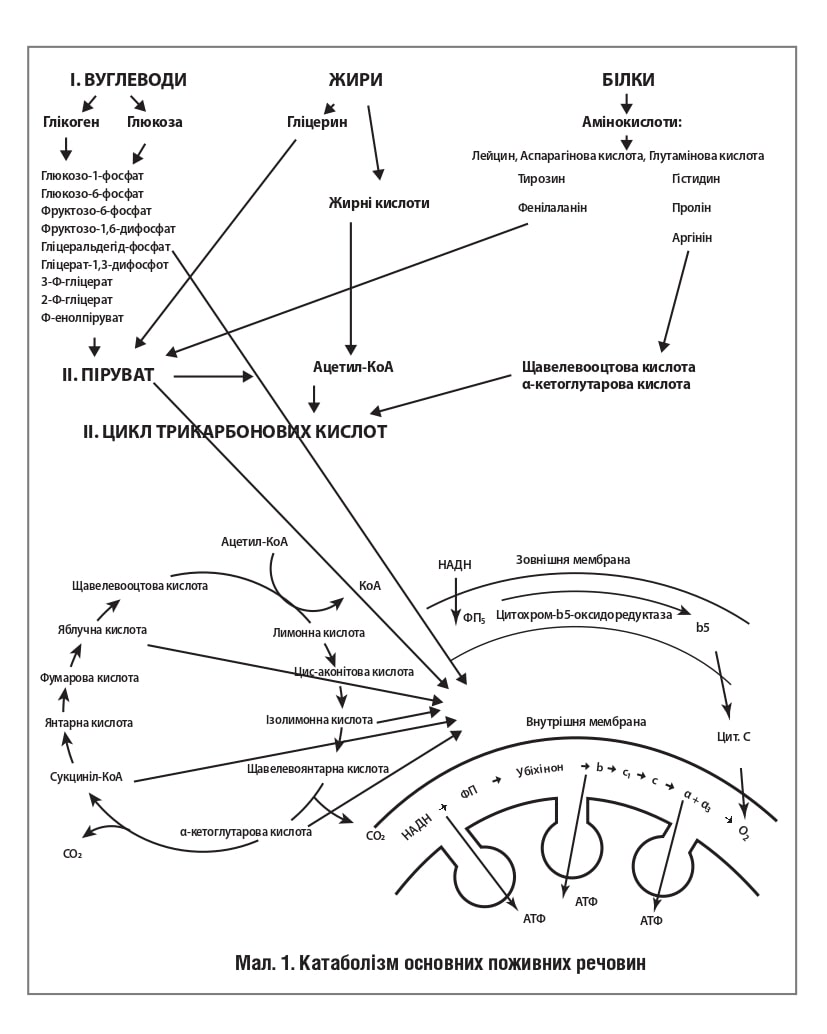 Підвищення біогенезу мітохондрій, а також збільшення швидкості й ефективності мітохондріального метаболізму, як, наприклад, при дієті з обмеженням калорій, сприяє покращенню енергозабезпечення клітин та подовженню життя.
Підвищення біогенезу мітохондрій, а також збільшення швидкості й ефективності мітохондріального метаболізму, як, наприклад, при дієті з обмеженням калорій, сприяє покращенню енергозабезпечення клітин та подовженню життя.
Наслідки мітохондріальної дисфункції
Мітохондріальна дисфункція, що характеризується втратою ефективності в електроннотранспортному ланцюзі та зменшенням синтезу високоенергетичних молекул, таких як АТФ, є характерною ознакою старіння й, по суті, усіх хронічних захворювань (Swerdlow R. H., 2011).
У процесі старіння спостерігається фрагментація мітохондрій та зміни їхнього об’єму. Ступінь цих змін зазвичай корелює з біологічним віком. Проте ці параметри не можуть бути використані для передбачення тривалості життя, оскільки вони є не причиною, а, швидше, наслідком процесу старіння. Слід додати, що накопичення мутантних копій матричної ДНК (мтДНК) і дисфункціональних мітохондрій, яке відбувається з віком, пов’язане передусім зі зниженням клітинної аутофагії, мітофагії та здатності видаляти пошкоджені нефункціональні розгорнуті білки.
Слід також згадати, що в кожній клітині людини, на відміну від усього двох копій ядерної ДНК, знаходяться ще сотні й навіть тисячі копій мтДНК. Із досягненням високої частоти шкідливих мутацій мтДНК при старінні (через те що пошкоджені й неефективні мітохондріальні клони поступово витісняють із клітини здорові й ефективні, що називається клональною експансією мутованої мтДНК) ризик розвитку мітохондріальної дисфункції зростає.
Із віком також розвивається дисфункція мітохондріальних пристосувальних реакцій, що може бути пов’язано з низькою ефективністю роботи НАДНдегідрогеназного комплексу – НАДНубіхіноноксидоредуктази, який каталізує перенесення електронів від НАДН до убіхінону/коензиму Q10 (CoQ10), результатом чого є зниження транспорту електронів і збільшення кількості АФК (рис. 2). Зниження рівня CoQ10 відіграє дуже важливу роль у процесах старіння, оскільки він є антиоксидантом і на відміну від інших антиоксидантів виробляється в організмі.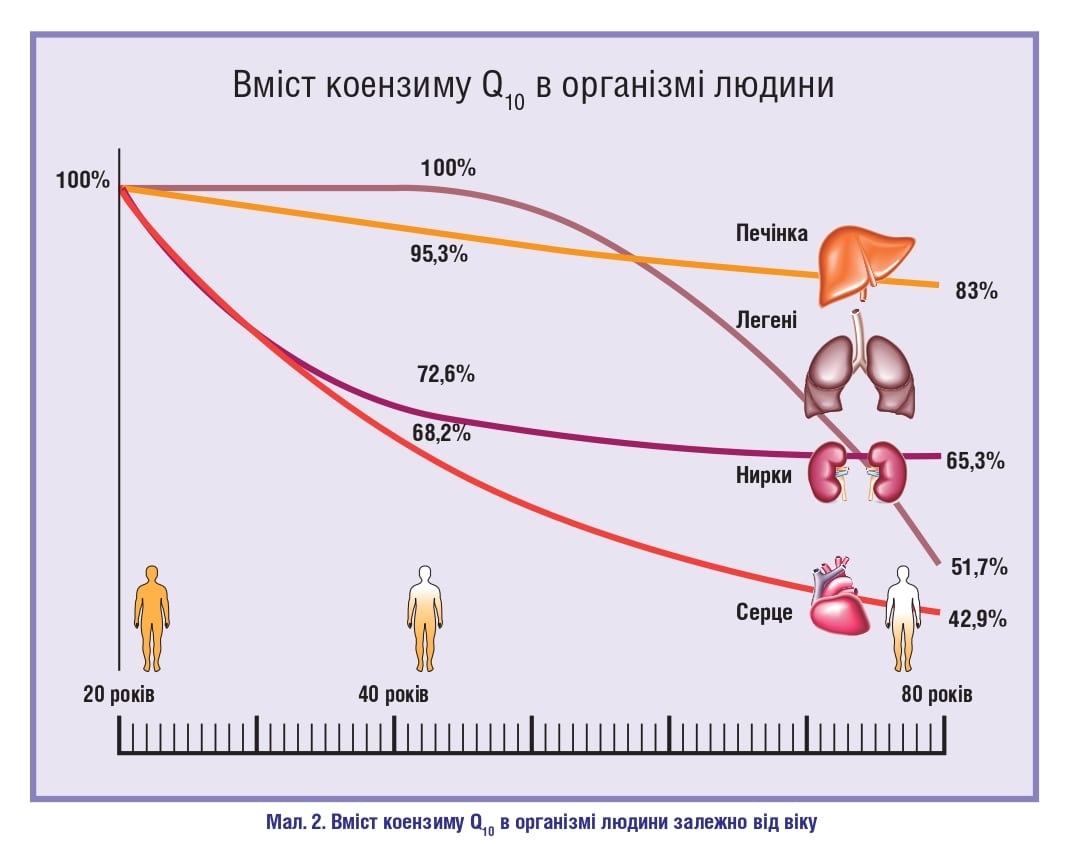 R. Stout та співавт. (2019) показали, що дисфункція мітохондрій й оксидативний стрес сприяють старінню шкіри, оскільки мітохондрії відіграють важливу роль у виробництві енергії, клітинній сигналізації, загоєнні ран, пігментації, ангіогенезі та рості волосся, а також у захисті від інфекцій. Також мітохондріальна дисфункція у поєднанні з порушенням механізмів відновлення призводить до дисфункції сітківки та втрати її клітин, наслідком чого є погіршення зору (Eells J. T., 2019).
R. Stout та співавт. (2019) показали, що дисфункція мітохондрій й оксидативний стрес сприяють старінню шкіри, оскільки мітохондрії відіграють важливу роль у виробництві енергії, клітинній сигналізації, загоєнні ран, пігментації, ангіогенезі та рості волосся, а також у захисті від інфекцій. Також мітохондріальна дисфункція у поєднанні з порушенням механізмів відновлення призводить до дисфункції сітківки та втрати її клітин, наслідком чого є погіршення зору (Eells J. T., 2019).
Крім того, при старінні організму, внаслідок порушення основних ланок метаболізму, з’являється невідповідність між отриманою енергією та необхідною. Наприклад, порушення вуглеводного обміну характеризується посиленням глюконеогенезу, підвищенням рівня гліколізу та розвитком інсулінорезистентності. За нормальних умов глюкоза є основним джерелом утворення АТФ у мітохондріях, однак за інсулінорезистентності вона не може в необхідній кількості проникати всередину клітини. Нестача глюкози змушує клітину перебудовуватися на інші шляхи енергозабезпечення, насамперед окислення жирних кислот. Однак окислення жирів є енерговитратним процесом, що потребує наявності АТФ, тому без енергії, яку постачають вуглеводи, жири окислюються не в повному обсязі – з утворенням кетонових тіл. Після виснаження буферного резерву кислотнолужна рівновага порушується, і розвивається метаболічний ацидоз (Montgomery M. K., 2019).
Ксилат сприяє стабілізації метаболічних процесів у пацієнтів із діабетом, а при його вживанні підвищується толерантність до глюкози. Ксилат має дуже низький глікемічний індекс, що забезпечує повільне, але стійке енергопродукування. Ксилат безпечний і не чинить негативного впливу на центральну нервову систему, обмін гормонів і нейротрансмітерів (Маньковський Б. М., 2015).
Також при діабеті аеробний гліколіз змінюється анаеробним, що є причиною виникнення лактатацидозу. Ще однією причиною збільшення рівня молочної кислоти є ефект Варбурга, а саме перемикання основного шляху енергопродукції у клітині з мітохондріального окисного фосфорилювання на менш ефективний анаеробний гліколіз, що характерно для пухлинних клітин. За цього ефекту клітини виробляють енергію переважно за допомогою дуже інтенсивного гліколізу з подальшим утворенням молочної кислоти. При цьому гліколіз залишається пріоритетним шляхом енергозабезпечення, навіть за умови надлишку кисню. При накопиченні молочної кислоти, яка утворюється при анаеробному гліколізі, у крові розвивається лактатацидоз, що викликає різкі порушення клітинного метаболізму (Pelicano H., 2006).
Існує безліч можливих пояснень ефекту Варбурга:
• пошкодження мітохондрій під час малігнізації;
• вимикання мітохондріальних генів, що беруть участь у запуску апоптозу клітин;
• швидка клітинна проліферація;
• підвищення експресії мітохондріальної гексокінази, відповідальної за стимуляцію гліколізу;
• синтез М2РКпіруваткінази – ферменту, який також може бути відповідальний за розвиток даного ефекту.
Загалом, ефект Варбурга можна розглядати як адаптаційний синдром, зумовлений необхідністю підтримки вироблення пухлинних клітин в умовах обмежених можливостей для утворення АТФ. Багато речовин, що інгібують ефект Варбурга, є на даний час предметом інтенсивних досліджень у якості протипухлинних агентів (SB‑204990, 2дезоксиDглюкоза, 3бромпіруват, 5тіоглюкоза, дихлороцтова кислота), що потенційно можуть поліпшити результати лікування онкологічних хворих (Burns J. S., 2017).
Ксилат – перспективний засіб впливу на метаболічну регуляцію при різних патологічних станах та процесах старіння
Завдяки здатності пригнічувати гіперактивний аеробний гліколіз за рахунок часткового заміщення глюкози (Курсов С. В., 2019), Ксилат може бути засобом енергетичного забезпечення в онкологічних пацієнтів. До того ж він має потужні антикетогенні властивості, зумовлені наступними ефектами препарату (Awuchi C. G., 2017):
• Ксилат шляхом метаболізму через пентозофосфатний цикл може бути джерелом тригліцерофосфату й тим самим зменшувати кількість вільних жирних кислот, здатних окислюватися в ацетилКоА. При цьому метаболізм відбувається незалежно від глюкозо‑6фосфатдегідрогенази, яка є неактивною при стресі, шоці та цукровому діабеті;
• підвищує інтенсивність гліколізу, посилює утворення піровиноградної кислоти, що є джерелом щавелевооцтової кислоти, яка сприяє окисленню ацетилКоА у циклі Кребса;
• сприяє підвищенню в печінці вмісту АТФ та інших аденілнуклеотидів;
• чинить стимулюючу дію на білковосинтетичну функцію печінки, зменшує кількість вільних жирних кислот у крові, знижує рівень плазматичного калію, збільшуючи його вміст у гепатоцитах, сприяє жовчовидільній функції;
• підсилює утворення глікогену в печінці, що знижує мобілізацію жиру на периферії й тим самим зменшує формування кетонових тіл;
• стимулює секрецію ендогенного інсуліну, що особливо позитивно позначається при метаболічному синдромі;
• індукує виділення ферментів підшлункової залози, особливо ліпази і трипсину.
Таким чином, Ксилат є потужним регулятором метаболізму мітохондрій, застосування якого сприяє нормалізації процесів обміну речовин та синтезу енергії. Терапія Ксилатом для підтримання енергетичного балансу клітин рекомендована курсом 1 раз на 3 міс протягом 5 днів по 400 мл зі швидкістю 50-70 крапель на хвилину.
Ксилат належить до групи багатокомпонентних поліфункціональних гіперосмолярних розчинів, який при внутрішньовенному введенні швидко включається у загальний метаболізм і чинить виражену антикетогенну, гемодинамічну, дезiнтоксикацiйну, реологiчну, енергетичну, залужнюючу та осмодіуретичну дію. Його застосування дозволяє зменшити iнтоксикацiю й покращити мікроциркуляцію, що особливо важливо для якісного та активного довголіття.
Висновки:
Ефективних заходів для уповільнення старості не так уже й багато, і спрямовані вони лише на кілька клітинних процесів, зокрема на сигналізацію поживних речовин, ефективність роботи мітохондрій, протеостаз та аутофагію. Активація метаболізму мітохондрій є перспективним напрямком профілактики старіння, оскільки дає змогу збалансувати обмінні процеси не лише у клітинах, а й в організмі в цілому.
Автори:
Е.Г. Манжалій, д. мед. н., доцент кафедри пропедевтики внутрішньої медицини №2 НМУ ім. О.О. Богомольця, президент Української печінкової фундації, виконавчий директор Інституту глобального довголіття, керівник гепатологічного центру клініки Verum Expert, м. Київ
Т.Ф. Татарчук, д. мед. н., професор, член-кор. НАМН України, заступник директора з наукової роботи, зав. відділенням ендокринної гінекології ДУ «ІПАГ ім. акад. О.М. Лук’янової НАМН України», зав. відділом репродуктивного здоров’я ДНУ
В.В. Дунаєвська, к. мед. н., лікар гінеколог-онколог Національного інституту раку, старший науковий співробітник відділення ендокринної гінекології ДУ «ІПАГ ім. акад. О.М. Лук’янової НАМН України», м. Київ
О.М. Бака, науковий співробітник відділу діагностики та лікування метаболічних захворювань, завідувачка гастроентерологічного відділення ДНУ «ЦІМТ НАН України», м. Київ



