Інтенсивна терапія септичних ускладнень в серцево-судинній хірургії
Національний медичний університет ім. акад. О.О. Богомольця, м.Київ
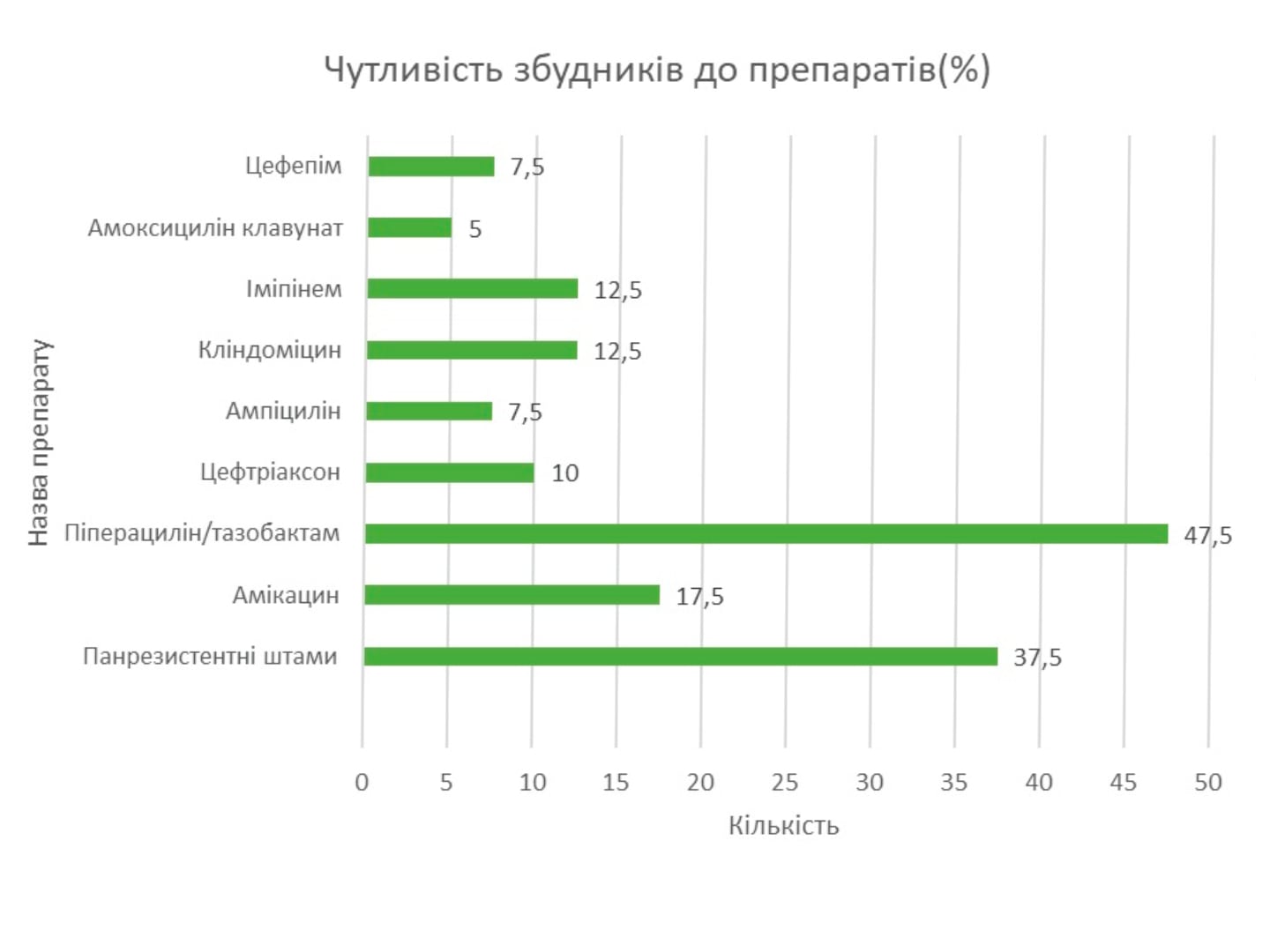
Резюме. Окрім стандартних схем інтенсивної терапії сепсису, грибкових ускладнень, в статті представлено досвід сучасної клініки судинної хірургії по запобіганню інфекційних ускладнень після реконструктивних операцій на серцево-судинній системі. Результати вивчення основної і контрольної груп показали високу ефективність використання вітчизняних лікарських засобів, зокрема: левофлоксацину, сорбілакту та реосорбілакту.
Ключові слова: сепсис, інфузійна та інтенсивна терапія, профілактика.
Вступ. У нормі систолічний об›єм лівого шлуночка становить близько 33 мл/м поверхні тіла, систолічний об’єм правого шлуночка – 43+10 млій». У нормі кінцеводіастолічний об›єм (діастолічна ємність) лівого шлуночка становить близько 89 мл/м» п. т., а правого – 143+ 25мл/м . Кінцевосистолічний об’єм або функціональна резидуальна ємність (резервний об’єм + залишковий об’єм) лівого шлуночка в нормі – 56 мл/м». Кінцеводіастолічний тиск в лівому шлуночку в нормі 5–7 мм. рт. ст., а в правому – 2–3мм. рт. ст. У разі, коли перед- і післянавантаження змінені, що має місце при септичних ускладненнях, скоротливість міокарда можна оцінювати за допомогою співставлення кінцево-систолічного тиску і кінцевосистолічного об’єму шлуночків. У разі септичних ускладнень кінцевосистолічний тиск зменшується, а кінцевовосистолічний об›єм збільшується, що свідчить про суттєве зниження скоротливості міокарда. Механізм зниження скоротливості міокарда, у разі септичних ускладнень, залишається до кінця не з’ясованим. Імовірно, що скорочувальну здатність міокарда пригнічують фактори, що циркулюють у крові і пригнічують міокард, коронарна гіпоперфузія, знижена чутливість бета-адренорецепторів, наявність серцево-судинних захворювань. Велике значення в формуванні симптомокомплексу септичних ускладнень мають деякі метаболіти арахідонової кислоти, яка звільняється при розпаді клітинних мембран. РG Е2 вважається потужним вазодилятатором і медіатором запалення. Він посилює проникливість судин і екстравазацію внутрішньосудинної рідини до тканин. Пошкоджувальна дія лейкотриєну В4 проявляється звуженням коронарних судин, негативним інотропним ефектом, зниженням скорочувальної здатності міокарда, гіпотензією. Тромбоксан А2 спричиняє тяжкі порушення коронарного кровообігу, що може закінчитися розвитком інфаркту міокарда і раптовою смертю. Вивільнення перерахованих вище цитокінів посилюється під впливом фактора некрозу пухлин – альфа (ФНП-альфа). Крім цього, ФНП-альфа сам спричиняє коронарну вазоконстрикцію і тромбоз. Ендогенний монооксид азоту прямо зменшує скоротливість міокарда. Значення кожного з цих факторів може варіювати у різних хворих.
Таким чином, інотропна підтримка серця вважається раціональною терапією як у разі гіпердинамічного, так і гіподинамічного варіантів гемодинаміки. Традиційно для інотропної підтримки застосовується допамін, адреналін, норадреналін, добутамін, допексамін, мілринон та амринон.
Допамін вважається вазоактивним препаратом вибору для пацієнтів з сепсисом. Однак у багатьох хворих низькі дози допаміну лише слабо поліпшують роботу шлуночків, а високі дози спричиняють надмірну вазоконстрикцію, тахікардію і тахіаритмію. Обмежена ефективність допаміну в разі септик шоку може бути наслідком зниження активності ферменту дофамін-бета – гідро-ксилази.
Адреналін у разі введення в помірних дозах (20–120нг/кг/хв.) підвищує артеріальний тиск, збільшує серцевий викид, ударний об›єм, а у високих дозах (500н7кгУхв) також підвищує системний судинний опір.
Добутамін збільшує серцевий викид і ударний об›єм, але з причин периферичного вазодилятаційного ефекту по-різному впливає на артеріальний тиск. Гіпотензія під час інфузії добутаміну може бути наслідком нерозпізнаної гіповолемії.
Допексамін має велику бета-адрененергічну і дофамінергічну активність, але альфа-адренергична активність у нього відсутня.
Якщо в септичних хворих зберігається артеріальна гіпотензія, незважаючи на екзогенне введення катехоламінів, то можуть бути застосовані інгібітори фосфодиестерази (ампінон, мелринон) і вазопресин. Однак досвід застосування цих препаратів у разі сепсису невеликий. Вазопресин ефективно ліквідує гіпотензію, але значна периферична та інтестінальна вазоконстрикція, яка при цьому розвивається, обмежує його застосування. Показання до інфузії вазопресину:
• стійка гіпотензія (систолічний АТ < 80 мм. рт. ст або середній АТ < 60 мм. рт. ст), незважаючи на адекватну інфузійну терапію (ЦВТ > 7 мм. рт. ст., тиск заклинювання легеневої артерії >10 мм. рт. ст.) і безперервне внутрішньовенне введення норадреналіну в дозі >0,2 мкг/кг/хв (приблизно 15 мкг/хв) з або без інфузій інших катехоламінів;
• відсутність гіповолемії, захворювань коронарних судин, серцевої недостатності (серцевий індекс > 2,5 л/хв/м, фракція викиду > 50%).
Вазопресин вводиться методом постійної внутрішньовенної інфузії в дозі 0,04 од/хв упродовж 16 годин. Він не впливає на показники оксигенації, вміст глюкози та електролітів.
Норадреналін поліпшує гемодинамічні показники у більшості статичних хворих і може поліпшувати утилізацію кисню тканинами. Усупереч переконанням багатьох лікарів, не існує даних, що норадреналін погіршує функції нирок. Застосування норадреналіну в септичних хворих цікаве тому, що цей препарат, як відомо, значно підвищує концентрацію в плазмі лактату зі зниженням рН крові. Це явище не спостерігається при застосуванні інших інотропних препаратів. Підвищення продукції лактату призводить до активації глікогенолізу і перерозподілу кровотоку. Це ж саме явище обмежує застосування фенілефрину (мезатону). Незважаючи на те, що цей препарат підвищує АТ і системний судинний опір, він, звичайно, знижує серцевий викид.
Упродовж останніх кількох років у численних роботах вчені вивчали вплив вазоконстрикторної терапії на перебіг септичного шоку. В основному така терапія підвищує периферичний судинний опір і АГ, не впливає на серцевий викид і посилює діурез. Отримані результати підтверджують доцільність використання вазоконстрикторів у разі септичного шоку (після оптимізації пе-реднавантаження і скоротливості). Схожі вазоконстрикторні впливи можуть бути досягнуті з допомогою норадреналіну, фенілфрину (мезатону) або високих доз допаміну.
Нині існують такі підходи до лікування гемодинамічних порушень у випадках септичного шоку. Терапія має базуватися на показниках інвазивного гемодинамічного моніторингу і моніторингу показників черезстравохідної ехокардіографії. Якщо серцевий викид адекватний (про адекватність серцевого викиду свідчить серцевий індекс – відношення хвилинного об›єму кровообігу до площі поверхні тіла), а саме серцевий індекс > 4,5 л/хв/м , концентрація лактату в плазмі < 2 ммоль/л, але АТ низький (САТ < 70мм. рт. ст.), то для підвищення системного судинного опору застосовується норадреналін. Якщо серцевий викид неадекватний (СІ < 4,5 л/хв/м2, концентрація лактату > 2 ммоль/л), то оптимізують переднавантаження, переливаючи внутрішньовенно рідини до досягнення плато на кривій Старлінга. Якщо після цього серцевий викид залишається неадекватним, то додають інотропну підтримку: якщо САТ < 70 мм. рт ст. – застосовують адреналін або комбінацію добутаміну з норадреналіном; якщо САТ > 70 мм. рт ст. – застосовують тільки добутамін. Важливим вважається той факт, що гемодинамічний статус постійно змінюється, тож необхідно часто робити переоцінку терапії.
Інтенсивне поповнення ОЦК вважається кращою початковою терапією для септичних хворих з нестабільною гемодинамікою. Гіпотензія часто може бути усунена тільки внутрішньовенним введенням рідини. Потреба в рідині для початкового поповнення у хворих з септичним шоком становить 10 л кристалоїдів або 4 л колоїдів у перші 24 години. Питання про застосування кристалоїдів або колоїдів (або обох) у септичних хворих залишається спірним. Кристалоїди рекомендуються як препарати першого вибору. Однак було встановлено, що поповнення об›єму колоїдними розчинами обмежує втрати рідини в «третій водний простір» у хворих з сепсисом. Розчини гідроксиетилкрохмалю теоретично мають перевагу. Розгалуджені молекули крохмалю закривають пори між ендотеліальними клітинами і таким чином знижують проникливість капілярів. Більше того, розчини гідроксиетилкрохмалю пригнічують активацію ендотеліоцитів і пов›язану з цим гіперкоагуляцію. У ряді досліджень було продемонстровано, що рН слизової оболонки шлунку і функції печінки значно ефективніше поліпшується у септичних хворих на тлі застосування гідроксиетилкрохмалю, ніж альбуміну. Крім того, розчини гідроксиетилкрохмалю спричиняють менший набряк тканин, ніж розчини кристалоїдів і забезпечують цілісність мікрокапілярного русла. Альбумін не рекомендується як об’ємний розширювач для септичних хворих, навіть для пацієнтів з гіпоальбумінемією. У таких хворих зареєстровано атипову відповідь на об’ємне навантаження, яка проявляється значно зменшеним підвищенням індексу викиду лівого шлуночка в порівнянні з контрольною групою хворих. Крім того, внаслідок значного зниження периферичного судинного опору у хворих зберігається гіпотензія, незважаючи на адекватну рідинну волемічну підтримку. Якщо гіпотензія або інші ознаки неадекватної органної перфузії зберігаються після адекватного рідинного навантаження, то має бути налагодженим інвазивний гемодинамічний моніторинг. Хоча користь від катетеризації легеневої артерії залишається не доведеною, ця процедура дозволяє раціонально проводити внутрішньовенну терапію розчинами і вазоактивними препаратами. Якщо після адекватного поповнення ОЦК у септичних хворих зберігається гіпотензія та ознаки органної дисфункції, то показано застосування вазоактивних препаратів, про які говорилося вище. Недостатність перфузії тканин може призвести до прогресування поліорганної дисфункції та смерті. Застосування вазопресорів у септичних хворих може давати недостатній гемодинамічний ефект, що часто вимагає збільшення їх дози, або супроводжуватися периферичним судинним спазмом. Це зводить нанівець їх позитивний ефект на показники центральної гемодинаміки.