Вплив нового акцептора вільних радикалів, Едаравону (MCI-186), на гострий інфаркт головного мозку
Дане багатоцентрове, рандомізоване, плацебо-контрольоване, подвійне сліпе дослідження було проведено для підтвердження ефективності едаравону (30 мг, внутрішньовенно, двічі на добу) з точки зору функціонального результату у пацієнтів з гострим ішемічним інсультом. Дослідження тривало понад 3 роки в 30 університетах та медичних закладах Японії за участю 250 пацієнтів. Результат оцінювався згідно з модифікованою шкалою Ренкіна при виписці протягом 3 місяців або через 3 місяці після початку захворювання. Крім того, було зібрано дані результатів через 3, 6 та 12 місяців після початку захворювання.
Дані, отримані в даному дослідженні, показали, що вплив едаравону на функціональний результат був значно перевершеним у порівнянні з показниками плацебо. Кожен третій пацієнт – повна відсутність постінсультних наслідків через 3 місяці після події за умови введення едаравону в перші 24 години після початку захворювання. Протягом 12 місяців спостереження результати показали тривалий терапевтичний ефект Едаравону у пацієнтів з гострим ішемічним інсультом. Основними побічними реакціями були шкірні висипання та порушення функції печінки, але їх частота або значно не відрізнялася між групами або була досить частішою у групі плацебо при розгляді інших побічних реакцій. Таким чином, з точки зору безпеки не було серйозних проблем.
Едаравон, новий акцептор вільних радикалів, демонструє нейропротекторний вплив, інгібуючи пошкодження клітин ендотелію судин та пом’якшуючи пошкодження нейронів у моделях ішемії мозку. Дане дослідження було проведено для перевірки його терапевтичної ефективності після гострого ішемічного інсульту. Ми провели багатоцентрове, рандомізоване, плацебо-контрольоване, подвійне сліпе дослідження на пацієнтах з гострим ішемічним інсультом, яке починалося протягом 72 годин після початку захворювання. Едаравон вводили в дозі 30 мг двічі на день протягом 14 днів.
При виписці пацієнта протягом 3 місяців або через 3 місяці після початку захворювання, проводилась оцінка функціонального результату за допомогою модифікованої шкали Ренкіна. Спочатку до дослідження було залучено двісті п’ятдесят два пацієнти. 125 з них були закріплені за групою “Едаравон”, та 125 – за групою “Плацебо” для аналізу. Два пацієнта були виключені через субарахноїдальний крововилив та синдром дисемінованого внутрішньосудинного згортання крові.
Значне покращення функціонального результату спостерігалося в групі едаравону за оцінкою модифікованої шкали Ренкіна (р = 0,0382). Едаравон являє собою нейропротекторний засіб, який потенційно корисний для лікування гострого ішемічного інсульту, оскільки він може значно впливати на функціональний результат у порівнянні з групою плацебо.
Ключові слова: едаравон; вільний радикал; гострий інсульт; клінічні випробування.
Введення
Накопичені дані демонструють, що вільні радикали відіграють вирішальну роль у пошкодженні головного мозку внаслідок ішемії [1-3]. При ішемічному стані прискорюється метаболізм арахідонової кислоти в тканині мозку [4, 5], в тому числі і в мікросудинах мозку [6], що призводить до збільшення кількості вільних радикалів. Вільні радикали спричиняють ураження мембрани шляхом перекисного окислення ненасичених жирних кислот у фосфоліпідах, що формують клітинні мембрани, і така травма послідовно прогресує, що призводить до ішемічного ураження головного мозку у вигляді смерті нейронів і набряку головного мозку [7].
Доведено, що новий акцептор вільних радикалів, Едаравон (MCI-186, 3-метил-1-феніл-2-піразолін-5-он, молекулярна вага: 174.20) інгібує перекисне окислення ліпідів [8] та пошкодження клітин ендотелію судин [9] in vitro. У моделях ішемії головного мозку щурів едаравон може зменшувати набряк головного мозку [10, 11], пошкодження тканин [8, 12, 13], пізню загибель нейронів [14] та неврологічні розлади [11, 12]. Крім того, він може запобігати церебральному вазоспазму в моделях субарахноїдальної кровотечі в експерименті на собаках [15].
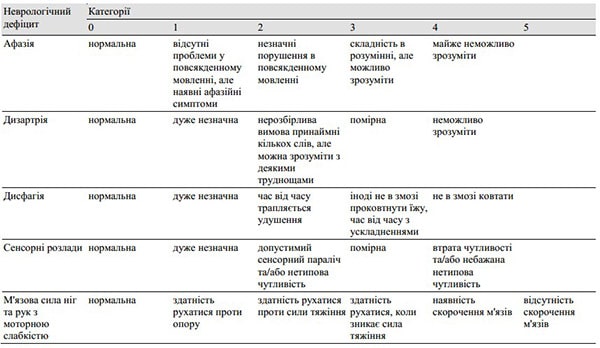
Таблиця 1. Ступінь неврологічного дефіциту
Таким чином очікується, що едаравон матиме нейропротекторний ефект у випадках гострого інфаркту мозку. Вперше він був оцінений на ранньому етапі 2 фази дослідження [16] при введенні 20, 30 та 60 мг препарату двічі на добу у 85 пацієнтів з гострим інфарктом мозку, а потім на пізньому етапі 2 фази подвійного сліпого дослідження [17] при введенні 10, 30 і 45 мг препарату двічі на добу, у 356 пацієнтів протягом 72 годин після початку захворювання. Результати цих клінічних досліджень показали позитивну динаміку при неврологічних розладах без виникнення серйозної небезпеки. На підставі наведених вище досліджень, найбільш адекватною вважається доза 30 мг (внутрішньовенно, двічі на добу) протягом 14 днів.
Дане багатоцентрове, рандомізоване, плацебо- контрольоване, подвійне сліпе дослідження було проведено для підтвердження ефективності едаравону (30 мг, внутрішньовенно, двічі на добу) з точки зору функціонального результату у пацієнтів з гострим ішемічним інсультом.
Матеріали та методи
Пацієнти
Дослідження проводилося в інститутах Японії з грудня 1993 року по березень 1996 року (див. Додаток).
Критерії для включення в дослідження були наступними: (1) стаціонарні пацієнти, які перенесли ішемічний інсульт не пізніше ніж впродовж попередніх 72 годин, включаючи пацієнтів, як з тромботичним, так з емболічним інсультом, і (2) пацієнти, рівень свідомості яких становив від 0 (при свідомості) до 30 (здатність до пробудження за допомогою механічних або вербальних подразників) за шкалою коми Японії[18]. Пацієнти, яких не можна було пробудити за допомогою сильних механічних подразників (рівні 100-300), були виключені.
До участі в дослідженні була отримана свідома згода від кожного пацієнта або найближчих родичів пацієнта, якщо пацієнт не був дієздатним, щоб взяти на себе цю відповідальність. Протокол та форма згоди, яку використовували під час дослідження, були затверджені наглядовою радою інституту для кожного центру, який брав участь. Дослідження проводилося у відповідності до “Правил клінічної практики” (Міністерство охорони здоров’я та добробуту Японії).
Досліджуваний препарат та випадковий розподіл
Препарат з активною діючою речовиною був наданий у 20-мл ампулах по 30 мг едаравону. Фізіологічний розчин, який не відрізняється від препарату з активною діючою речовиною, використовувався як плацебо. Корпорація Mitsubishi Pharma постачала досліджувані препарати. Контролер, який випадковим чином розподілив досліджувані препарати, підтвердив їх тотожність.
Спосіб застосування та дози
Одну ампулу розчиняли в 100 мл фізіологічного розчину і вводили внутрішньовенним крапельним вливанням протягом 30 хвилин кожні 12 годин протягом 14 днів. В разі необхідності внутрішньовенно вводили 400-600 мл 10% гліцерину. Впродовж всього періоду дослідження уникали використання фібринолітичних агентів (урокінази та рекомбінантного препарату тканинного активатора плазміногену), цитиколіну та озагрел натрію.
Параметри спостереження
Були зафіксовані такі характеристики пацієнта, як стать, вік, підтип інсульту, час до початку лікування після початку розвитку хвороби, рівень свідомості відповідно до шкали коми Японії, неврологічні розлади, оцінені відповідно до таблиці 1, асоційовані захворювання, а також результати КТ та МРТ. Тромботичні та емболічні інфаркти були діагностовані відповідно до критеріїв, запропонованих Мінематцу (Minematsu et al.) [19], в яких був включений тип початку захворювання, наявність або відсутність супутніх серцевих захворювань, та інші фактори.
Таблиця 2. Основні характеристики 
Результат оцінювався згідно з модифікованою шкалою Ренкіна [20] при виписці протягом 3 місяців або через 3 місяці після початку захворювання. Крім того, ми зібрали дані результатів через 3, 6 та 12 місяців після початку захворювання.
Фізіологічні обстеження та періодичні клінічні лабораторні дослідження (загальний та хімічний аналіз крові, аналіз сечі) проводилися перед початком лікування і на 7 та 14 день лікування.
Обробка даних пацієнтів
Обробка неповних даних пацієнтів обговорювалася Керівним комітетом (див. Додаток) до початку перерви. Дані були заблоковані, поки не зламали коди ключів, у подальшому аналіз даних був виконаний . Дані підлягали статистичному аналізу, в залежності від призначеного лікування (intent-to-treat analysis).
Статистичний аналіз
Порівняння модифікованої шкали Ренкіна були проведені за допомогою критеріїв суми рангів Уїлкоксона, причому критерій значущості був встановлений на рівні 5% (двосторонній).
Таблиця 3. Функціональний результат оцінювався при виписці протягом 3 місяців або через 3 місяці після початку захворювання, використовуючи модифіковану шкалу Ренкіна 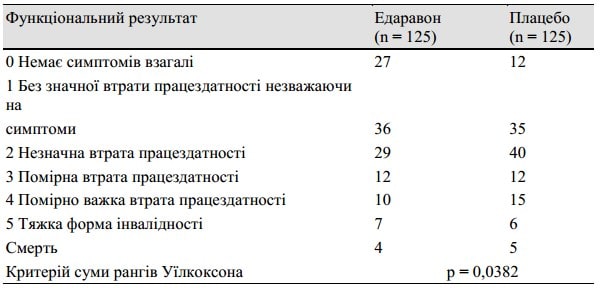
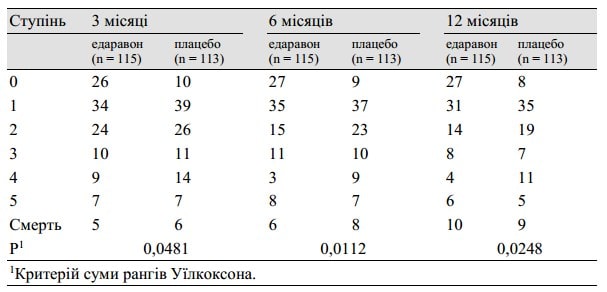
Таблиця 4. Оцінка за модифікованою шкалою Ренкіна здійснювалась через 3 місяці, та 12 місяців після початку захворювання
Результати
Всього було зареєстровано 252 пацієнти, з яких 125 ввійшли в групу едаравону, а 127 – групу плацебо. Серед них 1 пацієнт із групи плацебо, який переніс субарахноїдальний крововилив, та 1 пацієнт із групи плацебо, у якого відразу після початку лікування виявили синдром дисемінованого внутрішньосудинного згортання крові (ДВЗ) внаслідок пухлини яєчників, що зрештою помер у результаті черепно-мозкової грижі, яка розвинулась після геморагічного інфаркту, були виключені з аналізу. Таким чином, 250 пацієнтів, серед них 125 з групи едаравону та 125 з групи плацебо, були допущені до статистичного аналізу, в залежності від призначеного лікування (intent-to-treat analysis).
Характеристики пацієнтів з двох груп порівняли та відобразили у таблиці 2. Між обома групами не було різниці.
Ефективність
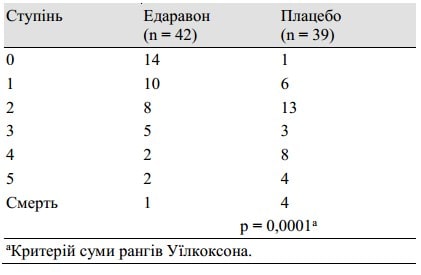
У таблиці 3 перераховані результати аналізу з використанням модифікованої шкали Ренкіна, виконаного при виписці пацієнта протягом 3 місяців або через 3 місяці після початку захворювання. Існувала значна відмінність (p = 0,0382, по критерію суми рангів Уїлкоксона) між групами на користь групи, в якій застосовували едаравону. Середній період від початку захворювання до проведення оцінки склав 49 днів у групі едаравону та 50 днів у групі плацебо. Крім того, на підставі даних результатів через 3, 6 та 12 місяців після початку захворювання, вищезазначений терапевтичний ефект зберігався відносно довше, як показано в таблиці 4. Коли підгруповий аналіз проводився для пацієнтів, які отримали лікування протягом 24 годин, різниця між цими двома групами була чіткішою, ніж у повному аналізі пацієнта, як показано у таблиці 5.
Безпека
Побічні реакції спостерігались у 9 пацієнтів (7%) у групі едаравону та у 14 пацієнтів (11%) у групі плацебо. Такі реакції в групі едаравону включали шкірні висипання у 4 пацієнтів, порушення функції печінки у 3, свербіж і нудоту у 1, а також лихоманку та порушення функції печінки в 1, але одужання було досягнуто протягом або після лікування.
Таблиця 5. Оцінка за модифікованою шкалою Ренкіна здійснювалась при виписці протягом 3 місяців або через 3 місяці після початку захворювання у пацієнтів, яким надавалось лікування протягом 24 годин з початку розвитку захворювання
У групі плацебо побічні реакції включали шкірні висипання у 2 пацієнтів, порушення функції печінки у 6, діарею, лихоманку та гостру ниркову недостатність у 1, схильність до кровотечі та ДВЗ у 1, збільшення кількості білих кров’яних тілець, лактатдегідрогенази та сироваткової амілази в 1, дискомфорт у епігастральній області у 1, приступи паніки та задишки в 1, анемія та порушення функції печінки в 1. Патологічні зміни в лабораторних дослідженнях спостерігалися головним чином за участю показників функцій печінки (аспартатамінотрансферази, аланінамінотрансферази, лактатдегідрогенази, лужної фосфатази, гамма-глютамілтранспептидази), і пропорції пацієнтів з такими змінами становили близько 10% у кожній групі.
Чотири пацієнти в групі едаравону та 5 пацієнтів у групі плацебо померли. Причинами смерті в групі едаравону були загострення інфаркту мозку, раптова зупинка серця, пневмонія та самогубство внаслідок психічної депресії по одній у кожного пацієнта, а відношення до досліджуваного препарату було визнано нульовим. У групі плацебо причини смерті включали загострення інфаркту мозку у 1 пацієнта, розширений набряк головного мозку або вклинення мигдалин мозочка у 2, пневмонію в 1 та синдром ДВЗ у 1 пацієнта, що, припускали, виник внаслідок великого інсульту та цирозу печінки.
Обговорення
Очікується, що нейропротекторні лікарські засоби продовжать терапевтичний часовий проміжок після інсульту при фібринолітичній терапії шляхом пригнічення загибелі клітин та блокування реперфузійних пошкоджень, а комбінація обох препаратів зможе забезпечити нову зброю для ефективного лікування інсульту в майбутньому [21]. Кілька досліджень показали наявність зони порогового кровотоку з частково збереженим енергетичним метаболізмом, так званої області “ішемічної напівтіні” (пенумбри), навколо ішемічного ядра в мозку експериментальних моделей на тваринах, а також у пацієнтів із інсультом, що дозволяє лікарським засобам досягти і запобігти розвитку інфаркту в цій області [22-24].
Лікарські засоби для лікування гострого ішемічного інсульту можна грубо розділити на антитромботичні засоби, такі як тромболітичні препарати, антикоагулянти та антитромбоцити, а також нейропротекторні засоби, такі як акцептори вільних радикалів.
Як повідомлялося, едаравон інгібує пошкодження клітин ендотелію судин [9], набряк головного мозку [10, 11], пошкодження тканин [8, 12, 13] та пізню загибель нейронів [14], а отже, зменшує неврологічні розлади [11, 12]. Крім того, було повідомлено про збереження N-ацетиласпартату, нейрон-специфічної амінокислоти, в ішемічному мозку пацієнтів, для лікування яких застосовували едаравон, як було виявлено при послідовних Магнітно-резонансних спектроскопічних дослідженнях (МРС) [25]. З точки зору хімічних характеристик, едаравон може пригнічувати пероксидацію фосфатидилхолінової ліпосомальної мембрани, ініційовану як водорозчинними, так і жиророзчиними радикалами, за що його можна порівняти з аскорбіновою кислотою та α-токоферолом, відомими антиоксидантами [26].
На відміну від супероксиддисмутази, ще одного акцептора вільних радикалів, який важко проникає в гематоенцефалічний бар’єр (ГЕБ), едаравон є низькомолекулярним акцептором радикалів, у якого, за оцінками, проникність в ГЕБ становить близько 60% [27], який усуває високо цитотоксичні гідроксильні радикали в мозку після внутрішньовенного введення [14]. Фактично, після введення едаравон може понижувати збільшення рівнів гідроксильних радикалів, які, як виявилося, переважно продукуються в перифокальній ішемічній ділянці, можливо, в ішемічній напівтіні (пенумбрі), що приводить до зменшення ступеня пошкодження головного мозку [13].
Едаравон не впливає на згортання крові, агрегацію тромбоцитів, фібриноліз або час кровотечі [28, 29], так що немає додаткового ризику кровотечі. Тому едаравон розглядається як готовий до застосування нейропротекторний препарат з ефектом поглинання вільних радикалів. Встановлено, що ефективна концентрація цього препарату при експериментах in vitro становить 10-6- 10-5 моль/л, а концентрація в плазмі при введенні ефективної дози під час проведення експериментів на тваринах становила 988-1,729 нг/мл (5,7-9,9 × 10– 6 моль/л) [30].
Фармакокінетикадосліджувалась на здорових добровольцях, і було виявлено, що Cmax (максимальна концентрація) та AUC (середня концентрація в сечі) зростають пропорційно до дози [31]. Крім того, було вказано, що концентрація препарату в плазмі крові літніх людей у тій самій дозі, яка застосовувалась в даному дослідженні, становить 1,041 нг/мл (6 × 10-6 моль/л) [32]. Ефективна концентрація в неклінічних дослідженнях та концентрація в плазмі, що зустрічається у реальній клінічній практиці, добре узгоджуються.
Що стосується часу лікування після початку інсульту, ми встановили критерій включення в дослідження протягом 72 годин, оскільки час не мав значного впливу на ефективність у пізній фазі 2 дослідження [17]. Взагалі, тривалість набряку мозку у людей у кілька разів перевищує такий показник у щурів, який демонструє тенденцію до зменшення після 3-х днів інфаркту [33]. Нещодавно “Матсуї та ін.” (Matsui et al.) [34] показали, що об’єм інфаркту повільно збільшується з 24 годин до 168 годин після постійної фокальної ішемії у щурів, а “Петерс та ін.” (Peters et al.) [35] запропонував використовувати тривалий оксидантний стрес після церебрального інфаркту, який може спричинити внутрішньо- паренхімальну інфільтрацію нейтрофілами, що призводить до окислювальних пошкоджень ГЕБ та нейронних клітин, які зберігаються щонайменше 5 днів або більше у пацієнтів [36].
Дані, отримані в даному дослідженні, показали, що едаравон вплив на функціональний результат був значно перевершеним порівняно з показниками плацебо. Протягом 12 місяців спостереження результати даних показали тривалий терапевтичний ефект Едаравону у пацієнтів з гострим ішемічним інсультом. Що стосується часу лікування після початку інсульту, то результати пацієнтів, яким надали лікування протягом 24 годин, були чіткішими, ніж у пацієнтів, які лікувалися протягом 72 годин після початку інсульту.
Основними побічними реакціями були шкірні висипання та порушення функції печінки, але їх частота або значно не відрізнялася між групами або була досить частішою у групі плацебо при розгляді інших побічних реакцій. Таким чином, з точки зору безпеки не було серйозних проблем.
Ці висновки дозволяють припустити, що едаравон має нейропротекторний ефект при застосуванні для людей, і перспективний потенціал для клінічного застосування. Окрім нейропротекторного ефекту, помітного з лікування, описаного вище, можна також очікувати, що едаравон, завдяки відсутності ризику кровотечі, запропонує майбутні переваги у комбінованій терапії фібринолітичними та антитромботичними засобами шляхом вилучення вільних радикалів, пов’язаних з травмами реперфузії, що призведе до розширення терапевтичного часового проміжку. Тому ми прийшли до висновку, що едаравон являє собою перспективний нейропротекторний засіб при лікуванні гострого ішемічного інсульту.
Додаток
Члени Керівного Комітету
Е. Отомо, доктор медичних наук (голова комітету),Терапія внутрішніх хвороб, Геріатрична лікарня Йокуфукай, Токіо; Х. Тогі, доктор медичних наук, Неврологія, Медичний університет Івате, Моріока; К. Когуре, доктор медичних наук, Терапія внутрішніх хвороб, лікарня Когуре, Фукая; С. Хірай, доктор медичних наук, Неврологія, університет Гунма, Маебаші; К. Такакура, доктор медичних наук, Нейрохірургія, Токійський жіночий медичний коледж, Токіо; А. Тераши, доктор медичних наук, Терапія внутрішніх хвороб, Медична школа Ніппона, Токіо; Ф. Гото, доктор медичних наук, Неврологія, Університет Кейо, Токіо; С. Маруяма, доктор медичних наук, Терапія внутрішніх хвороб, Центральна загальна лікарня Тода, Тода; Ю. Тазакі, доктор медичних наук, Неврологія, Університет Китасато, Сагаміхара; Ю. Шинохара, доктор медичних наук, Неврологія, Токайський університет, Ісехара; Е. Іто, доктор медичних наук, Неврологія, Національна лікарня Східної Нагоя, Нагоя; Т. Савада, доктор медичних наук, лабораторія B-F, Суїта; Т. Ямагучі, доктор медичних наук, Цереброваскулярний відділ, відділ медицини, Національний серцево-судинний центр, Суіта; Х. Кікучі, доктор медичних наук, Нейрохірургія, Центральна міська лікарня Кобе, Кобе; С. Кобаяши, доктор медичних наук, Терапія внутрішніх хвороб, Медичний університет Шимане, Ізюко; М. Фуджішима, доктор медичних наук, Терапія внутрішніх хвороб, Університет Кюсю, Фукуока; М. Накашима, доктор медичних наук (контролер), кафедра фармакології, медична школа медичного університету Хамамацу, Хамаматсу.
Центри, які брали участь
Нейрохірургія, Університет Хоккайдо; Неврологія, Університет Хоккайдо; Нейрохірургія, Нейрохірургічна меморіальна лікарня Хоккайдо; Нейрохірургія, Меморіальна лікарня Накамура; Нейрохірургія, Нейрохірургічна лікарня Кашіваба; Терапія внутрішніх хвороб, Лікарня Йікеікі; Неврологія, лікарня БібайРосай; Нейрохірургія, госпіталь Червоного Хреста Хакодате; Неврологія, Науково-дослідний інститут мозкових і кровоносних судин Акіта; Неврологія, Медичний університет Івате; Неврологія, Префектурна центральна лікарня Івате; Неврологія, Університет Тохоку; Неврологія, Лікарня Коннан; Терапія внутрішніх хвороб, Лікарня Сайто; Неврологія, Національна лікарня Міяги; Нейрохірургія, Центральна лікарня Айзю; Неврологічний інститут, лікарня Ота Атамі; Неврологія, Університет Ніїгата; Неврологія, Громадська лікарня Ніїгата; Неврологія, лікарня геріатричного інституту; Терапія внутрішніх хвороб, загальна лікарня ТоджіКеннан; Неврологія, лікарня СасіаїкіУцуномія; Терапія внутрішніх хвороб, госпіталь Червоного Хреста Охтавара; Неврологія, Лікарня Червоного Хреста Ашікага; Терапія внутрішніх хвороб, Лікарня Таджиригаока; Нейрохірургія, Школа медичного центру Сайтама; Неврологія, Міська лікарня Урава; Нейрохірургія, Головна лікарня Камеди; Нейрохірургія, Університет Токіо; Неврологія, Університет Токіо; Терапія внутрішніх хвороб, Медична школа Ніппона; Неврологія, Університет Кейо; Нейрохірургія, Токійський жіночий медичний коледж; Неврологія, Токійський жіночий медичний коледж; Терапія внутрішніх хвороб, Токійська жіноча медична колегія, 2-а лікарня; Нейрохірургія, лікарня Метрополітен Бокуту, Токіо; Терапія внутрішніх хвороб, Центральна лікарня Токіо Сасейкай; Нейрохірургія, Лікарня Кейї; Терапія внутрішніх хвороб, лікарня Косі; Терапія внутрішніх хвороб, Геріатрична лікарня Йокуфукай; Нейрохірургія, Кіорінський університет; Неврологія, Загальна лікарня Шоуа; Неврологія, Токійський геріатричний медичний центр МетрополітанТама; Терапія внутрішніх хвороб, Міська Лікарня Іда Кавасакі; Неврологія, Міська Лікарня Іда Кавасакі; Неврологія, Лікарня університету Фудзігаока, Шоуа; Терапія внутрішніх хвороб, Університет Кітасато; Неврологія Токайського університету; Терапія внутрішніх хвороб, лікарня Токайського університету Ойсо; Терапія внутрішніх хвороб, міська лікарня Одавара; Нейрохірургія, лікарня інституту мозку Фудзі; Неврологія, міська лікарня міста Шимидзу; Неврологія, Національна лікарня Східної Нагої; Терапія внутрішніх хвороб, Національна лікарня Нагоя; Неврологія, 1-ий госпіталь Червоного Хреста Нагої; Неврологія, 2-ий госпіталь Червоного Хреста Нагоя; Неврологія, лікарня Нагоя Екісайкай; Неврологія, лікарня Чукьо; Неврологія, лікарня Чубу Росай; Неврологія, Університет охорони здоров’я Фудзіта; Неврологія, Загальна лікарня Тосей; Неврологія, Госпіталь префектури Тажімі в Гіфу; Неврологія, Загальна міська лікарня Токі; Неврологія, Університет Мей; Неврологія, Центральна загальна лікарня Мацусака; Неврологія, медичний коледж Канадзава; Нейрохірургія, Медичний центр Шіги для хвороб дорослих; Нейрохірургія, Університет Кіото; Терапія внутрішніх хвороб, Префектурний університет м. Кіото; Неврологія, Префектурний університет м. Кіото; Нейрохірургія, Лікарня Шимидзу; Терапія внутрішніх хвороб, Університет Осака; Неврологія, Університет Осака; Терапія внутрішніх хвороб, Національний серцево- судинний центр; Цереброваскулярний відділ, кафедра медицини, Національний серцево-судинний центр; Нейрохірургія, лікарня Червоного Хреста, Осака; Нейрохірургія, нейрохірургічна лікарня Томінага; Терапія внутрішніх хвороб, Національна лікарня Осаки; Терапія внутрішніх хвороб, лікарня Осака Росай; Кафедра цереброваскулярних хвороб, Християнська лікарня Йодогава; Неврологія, Лікарня Китано; Терапія внутрішніх хвороб, лікарня Кобе Екісайкай; Нейрохірургія, університет Окаяма; Нейрохірургія, лікарня Косеї; Нейрохірургія, лікарня Каджікава; Нейрохірургія, Університет Тотторі; Неврологія, Університет Тотторі; Нейрохірургія, Лікарня Ножіма; Терапія внутрішніх хвороб, Медичний університет Шимане; Терапія внутрішніх хвороб, лікарня ЦуваноКіозон; Терапія внутрішніх хвороб, лікарня НічіхараКьозон; Неврологія, Університет Ямагучі; Неврологія, Головна лікарня Сйуто; Нейрохірургія, Університет Токусіма; Нейрохірургія, лікарня Таока; Неврологія, лікарня Кюсю Росай; Відділення Інсульту, лікарня Кюсю Росай; Нейрохірургія, Лікарня міста Ятата, Кита-Кюсю; Терапія внутрішніх хвороб, Університет Кюсю; Терапія внутрішніх хвороб, лікарня Ягі; Терапія внутрішніх хвороб, Університет Куруме; Кафедра цереброваскулярної хвороби, лікарня Святої Марії; Терапія внутрішніх хвороб, лікарня ОмутаРосай; Терапія внутрішніх хвороб, Східна національна лікарня Фукуока; Нейрохірургія, Загальна лікарня міста Сасебо; Нейрохірургія, Університет Нагасакі; Терапія внутрішніх хвороб, Університет Кагосіма; Неврологія, лікарня Кікуно.
Подяка
Ми висловлюємо подяку Т. Нагай, доктору фармацевтичних наук, Університет Хоші, за проведення фармацевтичного дослідження. Корпорація Mitsubishi Pharma, Японія, підтримала це дослідження.
Автори:
Група досліджень гострих інфарктів мозку щодо Едаравону (Голова: Ейічі Отомо, доктор медичних наук).
Література:
- KontosHA: George E Brown memorial lecture. Oxygen radicals in cerebral vascular injury. Circ Res 1985;57:508–516.
- SchmidleyJW: Free radicals in central nervous system ische Stroke 1990;21:1086–1090.
- Halliwell B: Reactive oxygen species and the central nervous syste J Neurochem 1992;59: 1609–1623.
- Gaudet RJ, Levine L: Transient cerebral ischemia and brain prostaglandins. BiochemBiophys Res Commun 1979;86:893– 901.
- Moskowitz MA, Kiwak KJ, Hekimian K, Levine L: Synthesis of compounds with properties of leukotrienes C4 and D4 in gerbil brains after ischemia and reperfusion. Science 1984; 224:886–889.
- Asano T, Gotoh O, Koide T, Takakura K: Ischemic brain edema following occlusion of the middle cerebral artery in the r II. Alteration of the eicosanoid synthesis profile of brain microvessels. Stroke 1985;16:110– 113.
- Chan PH, Fishman RA, Longar S, Chen S, Yu A: Cellular and molecular effects of polyunsaturated fatty acids in brain ischemia and injury. Prog Brain Res 1985;63:227–235.
- Watanabe T, Yuki S, Egawa M, Nishi H: Protective effects of MCI-186 on cerebral ischemia: Possible involvement of free radical scavenging and antioxidant actions. J PharmacolExpTher 1994;268:1597–1604.
- Watanabe T, Morita I, Nishi H, Murota S: Preventive effect of MCI-186 on 15-HPETE induced vascular endothelial cell injury in vitro. Prostaglandins LeukotEssent Fatty Acids 1988;33:81–87.
- Abe K, Yuki S, Kogure K: Strong attenuation of ischemic and postischemic brain edema in rats by a novel free radical scavenger. Stroke 1988;19:480–485.
- Nishi H, Watanabe T, Sakurai H, Yuki S, Ishibashi A: Effect of MCI-186 on brain edema in ra Stroke 1989;20:1236–1240.
- Kawai H, Nakai H, Suga M, Yuki S, Watanabe T, Saito K: Effects of a novel free radical scavenger, MCI-186, on ischemic brain damage in the rat distal middle cerebral artery occlusion model. J PharmacolExpTher 1997;281:921– 927.
- Mizuno A, Umemura K, Nakashima M: Inhibitory effect of MCI-186, a free radical scavenger, on cerebral ischaemia following rat middle cerebral artery occlusion. Gen Pharmacol 1998;30:575–578.
- Yamamoto T, Yuki S, Watanabe T, Mitsuka M, Saito K, Kogure K: Delayed neuronal death prevented by inhibition of increased hydroxyl radical formation in a transient cerebral ischemia. Brain Res 1997;762:240– 242.
- Nakagomi T, Yamakawa K, Sasaki T, Saito I, Takakura K: Effect of edaravone on cerebral vasospasm following experimental subarachnoid hemorrhage. J Stroke Cerebrovasc Dis, in press.
- Otomo E, Tohgi H, Kogure K, Hirai S, Terashi A, Gotoh F, Tazaki Y, Ito E, Sawada T, Kobayashi S, Fujishima M, Nakashima M: Clinical efficacy of a free radical scavenger, MCI-186, on acute cerebral infarction: Early phase II clinical trial. Ther Res 1998;19:1311–1332.
- MCI-186 Acute Cerebral Infarction Study Group: Late phase 2 clinical trial of MCI-186 on acute cerebral infarction: A dose-finding double-blind study (in Japanese). J ClinExp Med 1998;185:841–863.
- Ohta T, Kikuchi H, Hashi K, Kudo Y: Nizofenone administration in the acute stage following subarachnoid hemorrhage: Results of a multi-center controlled double-blind clinical study. J Neurosurg 1986;64:420–426.
- Minematsu K, Yamaguchi T, Omae T: Spectacular shrinking deficit: Rapid recovery from a major hemispheric syndrome by migration of an embolus. Neurology 1992;42:157–162.
- vanSwietenJC, KoudstaalPJ, Visser MC, Schouten HJA, van Gijn J: Interobserver agreement for the assessment of handicap in stroke patien Stroke 1988;19:604–607.
- Barinaga M: Finding new drugs to treat stroke. Science 1996;272:664–666.
- Astrup J, Siesjo BK, Symon L: Thresholds in cerebral ischemia: The ischemic penumbra. Stroke 1981;12:723–725.
- Hossmann KA: Viability thresholds and the penumbra of focal ischemia. Ann Neurol 1994; 36:557–565.
- Fisher M: Characterizing the target of acute stroke therapy. Stroke 1997;28:866–872.
- Houkin K, Nakayama N, Kamada K, Noujou T, Abe H, Kashiwaba T: Neuroprotective effect of the free radical scavenger MCI-186 in patients with cerebral infarction: Clinical evaluation using magnetic resonance imaging and spectroscopy. J Stroke Cerebrovasc Dis 1998;7: 1–9.
- Yamamoto Y, Kuwahara T, Watanabe K, Watanabe K: Antioxidant activity of 3- methyl-1-phenyl-2-pyrazolin-5-one. Redox Rep 1996;2: 333–338.
- Takamatsu Y, Watanabe T: Studies on the concentrations of 3-methyl-1-phenyl-2- pyrazolin-5-one (MCI-186) in dog plasma and cerebral spinal flui JpnPharmacolTher 1997; 25(suppl):1793–1797.
- Ando K, Nishi H, Watanabe T, Watanabe Y, Yuki S, Sugasawa K, Horii D, Ishibashi A, Kimura A, Nakano D, Morinaga T: General pharmacological studies of 3-methyl-1- phenyl- 2-pyrazolin-5-one (MCI-186), a novel radical scavenging agent. JpnPharmacolTher 1997; 25(suppl):1723–1753.
- Watanabe Y, Watanabe T, Ando K, Yuki S, Saito K, Ishibashi A: Drug interaction between radical scavenger, 3-methyl-1- phenyl-2-pyra-zolin-5-one (MCI-186), and stroke-medicating agents. JpnPharmacolTher 1997;25(suppl): 1709–1718.
- Takamatsu Y, Yuki S, Watanabe T: Studies on the concentrations of 3-methyl-1-phenyl-2- pyrazolin-5-one (MCI-186) in MCA occlusion and reperfusion model of r JpnPharmacolTher 1997;25(suppl):1785– 1791.
- Shibata H, Arai S, Izawa M, Murasaki M, Takamatsu Y, Izawa O, Takahashi C, Tanaka M: Phase I clinical study of MCI-186 (edaravone, 3-methyl-1-phenyl-2-pyrazoline- 5-one) in healthy volunteers: Safety and pharmacokinetics of single and multiple administrations. Jpn J ClinPharmacolTher 1998;29:863–876.
- Yokota S, Kumagai Y, Uchiumi M, Isawa S, Murasaki M, Akimoto K, Iwamoto M, Yuasa T, Iwano M: A pharmacokinetic study of MCI-186, a novel drug for cerebrovascular disease in elderly and young healthy subje Jpn J ClinPharmacolTher 1997;28:693–702.
- Gotoh O, Koide T, Asano T, Takakura K, Tamura A, Sano K: A model to study ischemic brain edema in rats and the influence of drugs; in Go KG, Baethmann A (eds): Recent Progress in the Study and Therapy of Brain Edema. Plenum Press, 1984, pp 499– 508.
- Matsui T, Mori T, Tateishi N, Kagamiishi Y, Satoh S, Katsube N, Morikawa E, Morimoto T, Ikuta F, Asano T: Astrocytic activation and delayed infarct expansion after permanent focal ischemia in rats. I. Enhanced astrocytic synthesis of s-100ß in the periinfarct area precedes delayed infarct expansion. J Cereb Blood Flow Metab 2002;22:711–722.
- Peters O, Back T, Lindauer U, Busch C, Megow D, Dreier J, Dirnagl U: Increased formation of reactive oxygen species after permanent and reversible middle cerebral artery occlusion in the ra J Cereb Blood Flow Metab 1998;18: 196–205.
- Wang PY, Kao CH, Mui MY, Wang SJ: Leukocyte infiltration in acute hemispheric ischemic stroke. Stroke 1993;24:236–240.



