Пиперациллин/тазобактам в современной клинической практике
Резюме: Пиперациллин/тазобактам представляет собой комбинацию уреидопенициллина пиперациллина и ингибитора β-лактамаз тазобактама. Антибиотик является общепризнанным препаратом выбора для лечения тяжёлых инфекций, прежде всего в хирургических отделениях и отделениях реанимации и интенсивной терапии. Область клинического использования пиперациллина/тазобактама включает в себя интраабдоминальные инфекции, инфекции кожи и мягких тканей, поздние нозокомиальные пневмонии, в том числе в условиях пандемии ковид-19, инфекции других локализаций.
Эффективность вмешательства повышается при внутривенном введении препарата методом продлённых инфузий. В Украине установлена высокая чувствительность большинства возбудителей раневой инфекции к пиперациллину/тазобактаму (за исключением Klebsiella spp. и неферментирующих бактерий). Препарат может использоваться у больных с аллергическими реакциями на β-лактамы в анамнезе; предварительное аллергологическое тестирование показано только в случаях аллергии на аминопенициллины и аминоцефалоспорины. На рынке Украины зарегистрирован первый отечественный пиперациллин/тазобактам под названием Рефекс.
Ключевые слова: пиперациллин/тазобактам, продлённые инфузии, антибиотикочувствительность, нозокомиальные пневмонии, Рефекс.
Введение
Пиперациллин/тазобактам представляет собой комбинацию уреидопенициллинапиперациллина и ингибитора β-лактамазтазобактама. Зарегистрирован FDA(Комиссией по контролю качества продуктов питания и лекарственных средств США) в 1993 г. Основными показаниями к применению этого антибиотика являются: 1) интраабдоминальные инфекции; 2) инфекции кожи и мягких тканей; 3) инфекции таза у женщин; 4) внебольничные пневмонии и 5) нозокомиальные (госпитальные) пневмонии [1]. В начале 2022 г. на рынке Украины ожидается появление первого отечественного пиперациллина/тазобактама (ПТЗ) под названием «РЕФЕКС» производства компании «Юрия-фарм».
Спектр антимикробной активности препарата охватывает широкий ряд грамположительных бактерий (включая золотистые и эпидермальные стафилококки (чувствительные к метициллину), пневмококки, стрептококки, фекальные энтерококки), грамотрицательных микроорганизмов (гемофильные палочки, моракселлы, представители семейства Enterobacterales (кишечная палочка, клебсиелла, протей и др.), неферментирующие глюкозу бактерии (синегнойная палочка, ацинетобактер)) и анаэробов.
Наличие тазобактама придаёт ПТЗ устойчивость к действию большинства (но не всех) бактериальных β-лактамаз, включая β-лактамазы расширенного спектра действия (БЛРС), что позволяет с успехом использовать препарат для лечения многих инфекций, вызванных «проблемными» (т.е. множественнорезистентными, MDR) возбудителями.
Фармакокинетические/фармакодинамические (ФК/ФД) характеристики и особенности дозирования ПТЗ у больных в критическом состоянии
Для того, чтобы антибиотик оказался полезным в клинических условиях, недостаточно одной только чувствительности к нему предполагаемого или выделенного возбудителя (либо возбудителей). Важно, чтобы достигались ФК/ФД критерии эффективности.
В частности, для пенициллинов (и, соответственно, для пиперациллина) ФК/ФД критерием оказания бактерицидного действия является 50%fТ >МПК, когда плазменная концентрация несвязанного с белками антибиотика (f) превышает минимальную подавляющую концентрацию (МПК) возбудителя на протяжении не менее 50% интервала времени (Т) между введением очередных доз препарата. При этом максимальное уничтожение (эрадикация) бактерий достигается при длительном 4-5-кратном превышении плазменной концентрации антибиотика над МПК возбудителя [2–4], а клинические данные свидетельствуют, что оптимальная эффективность препаратов у больных в критическом состоянии наблюдается при 100% fТ >МПК [5].
Простейший путь для достижения указанной выше ФК/ФД цели при использовании ПТЗ – это увеличение кратности введения. Например, вероятность достижения 100% fТ >МПК выше при внутривенном (в/в) введении препарата по 3,375 г 4 р/сут., чем по 4,5 г 3 р/сут., хотя суточная доза в обоих случаях одинаковая [6]. Другим путём является увеличение продолжительности инфузии до 3–4-х часов или постоянная инфузия антибиотика, которые позволяют существенно увеличить вероятность достижения целевых ФК/ФД параметров.
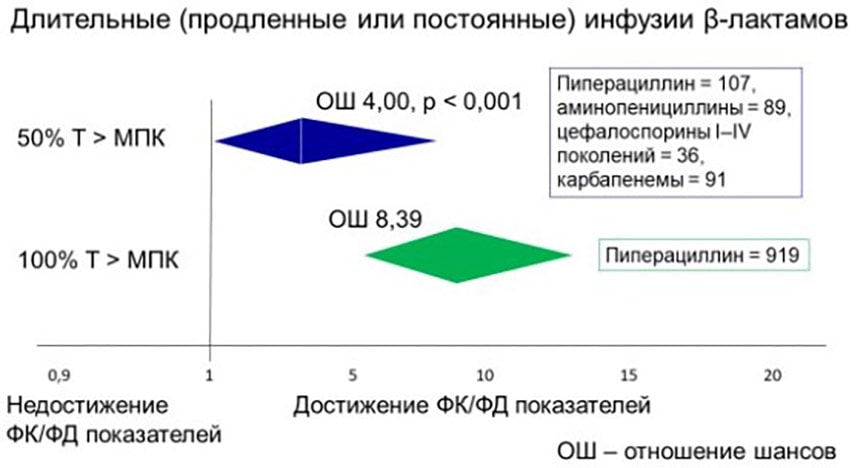
В исследованиях последних лет было показано, что длительные (продлённые и постоянные) инфузии β-лактамов (включая пиперациллин) по сравнению с болюсным введением повышают вероятность достижения показателя 50% fТ >МПК в 4 раза (95% доверительный интервал (ДИ) 0,02 – 8,33, р<0,001) [7], а показателя 100% fТ >МПК (при введении одного только пиперациллина) – более, чем в 8 раз (95% ДИ 5,35–13,17) [8], рис. 1.
Рисунок 1. Длительные инфузии β-лактамов как предсказатели достижения целевых ФК/ФД показателей у больных в критическом состоянии в начале эмпирической антибактериальной терапии.
 Оптимизация дозирования антибиотиков непосредственно влияет на исходы лечения пациентов. По результатам мета-анализа 17 рандомизированных клинических исследований (РКИ), длительные инфузии по сравнению с болюсным введением β-лактамов у взрослых больных сепсисом или септическим шоком ассоциируются со снижением краткосрочной (в пределах 1 мес.) смертности на 30%: относительный риск (ОР) 0,70 (95% ДИ 0,57–0,87) [9].К сожалению, до настоящего времени не проведено ни одного РКИ, в котором бы изучалась долгосрочная смертность (> 90 дней) при использовании длительного и болюсного введения β-лактамов.
Оптимизация дозирования антибиотиков непосредственно влияет на исходы лечения пациентов. По результатам мета-анализа 17 рандомизированных клинических исследований (РКИ), длительные инфузии по сравнению с болюсным введением β-лактамов у взрослых больных сепсисом или септическим шоком ассоциируются со снижением краткосрочной (в пределах 1 мес.) смертности на 30%: относительный риск (ОР) 0,70 (95% ДИ 0,57–0,87) [9].К сожалению, до настоящего времени не проведено ни одного РКИ, в котором бы изучалась долгосрочная смертность (> 90 дней) при использовании длительного и болюсного введения β-лактамов.
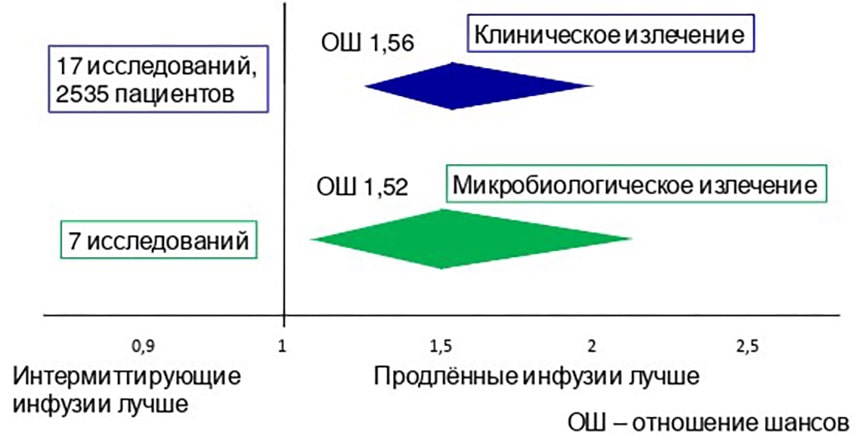
В мета-анализе 23 исследований (10 РКИ, 12 обсервационных (в том числе 2 проспективных), 1 квазирандомизированное), в которых сравнивались длительное (продлённая и постоянная инфузия) и интермиттирующее введение ПТЗ у взрослых больных в критическом состоянии установлено, что длительные инфузии ассоциировались с лучшим клиническим и микробиологическим излечением (рис. 2), меньшей смертностью (рис. 3) и меньшей длительностью пребывания больных в стационаре (средняя разница -1,23 дня, 95% ДИ [-2,25]–[-0,08]).
Под клиническим излечением понимали полное исчезновение жалоб и клинических симптомов инфекции при отсутствии новых жалоб или симптомов, связанных с исходной инфекцией, под микробиологическим излечением – эрадикацию и предполагаемую эрадикацию микроорганизмов в очаге инфекции [10, 11].Частота нежелательных лекарственных явлений при сравнении разных режимов введения ПТЗ не различалась (рис. 3) [10].
Рисунок 2. Клиническое и микробиологическое излечение у взрослых больных в критическом состоянии при использовании разных методов введения пиперациллина/тазобактама.
 Примечание к рис. 2, 3, 5. Параметры, которые сравниваются, указаны ниже оси абсцисс (ось Х). Вершина ромба соответствует вероятности (отношению шансов) того, что некое событие (указано рядом с ромбом) произойдёт, ширина ромба по горизонтали – границам доверительного интервала.
Примечание к рис. 2, 3, 5. Параметры, которые сравниваются, указаны ниже оси абсцисс (ось Х). Вершина ромба соответствует вероятности (отношению шансов) того, что некое событие (указано рядом с ромбом) произойдёт, ширина ромба по горизонтали – границам доверительного интервала.
Когда горизонтальные границы ромба не пересекают вертикальную линию (т.е. ромб находится слева или справа от неё), это означает, что различия между сравниваемыми параметрами по вероятности возникновения конкретного события статистически значимы. Если же ромб какой-то частью пересекает вертикальную линию, то, НЕЗАВИСИМО от значения ОШ, статистически значимые различия отсутствуют.
Например, вероятность и клинического, и микробиологического излечения после завершения курса антибактериальной терапии в случае использования длительных инфузий ПТЗ примерно в 1,5 раза выше (и эти различия статистически значимы), чем при введении антибиотика с помощью традиционных интермиттирующих инфузий (длительностью 30 мин. каждая) (рис. 2).
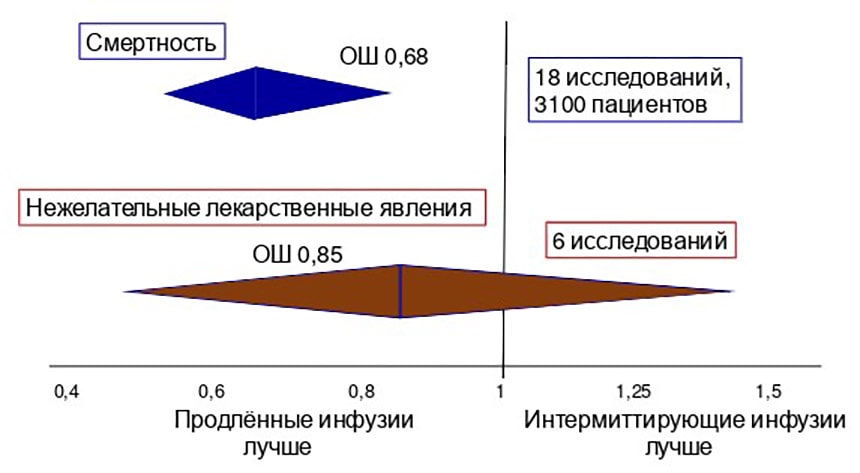
Вероятность смерти при использовании длительных инфузий ПТЗ статистически значимо ниже, чем при интермиттирующем введении (примерно в 1,5 раза, или на 32%), а вот различия в частоте нежелательных лекарственных явлений при введении ПТЗ с помощью длительных или интермиттирующих инфузий отсутствуют (границы ромба пересекают вертикальную линию, рис. 3).
Рисунок 3. Смертность и нежелательные лекарственные явления у взрослых больных в критическом состоянии при использовании разных методов введения пиперациллина/тазобактама.
 Следует добавить, что продолжительность инфузии ПТЗ – далеко не единственный параметр, который ассоциируется с вероятностью достижения целевых ФК/ФД показателей. Наиболее выраженное негативное влияние на достижение этих показателей оказывают (в порядке уменьшения убедительности доказательств) повышенный почечный клиренс, более молодой возраст и мужской пол. В общем виде эти и другие факторы представлены на рис. 4[12].
Следует добавить, что продолжительность инфузии ПТЗ – далеко не единственный параметр, который ассоциируется с вероятностью достижения целевых ФК/ФД показателей. Наиболее выраженное негативное влияние на достижение этих показателей оказывают (в порядке уменьшения убедительности доказательств) повышенный почечный клиренс, более молодой возраст и мужской пол. В общем виде эти и другие факторы представлены на рис. 4[12].
Рисунок 4. Демографические и клинические факторы, которые ассоциируются с достижением целевых ФК/ФД показателей при лечении β-лактамами.
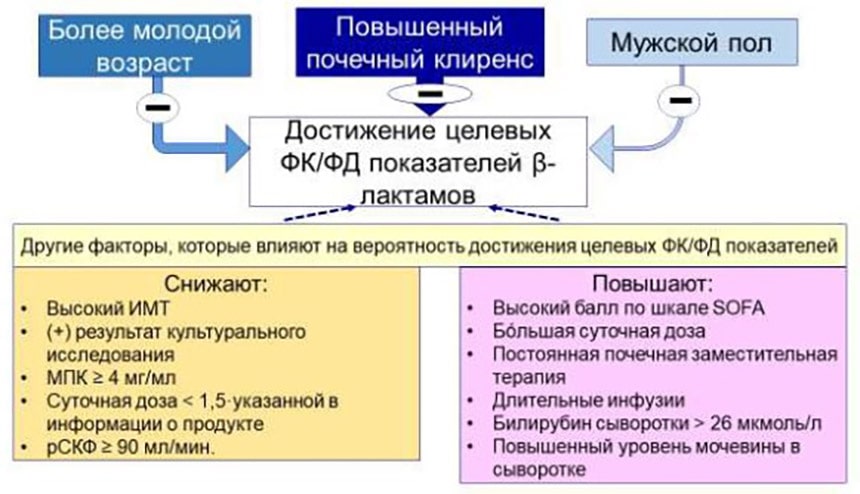 Примечания: ИМТ – индекс массы тела, МПК – минимальная подавляющая концентрация, рСКФ – расчётная скорость клубочковой фильтрации.
Примечания: ИМТ – индекс массы тела, МПК – минимальная подавляющая концентрация, рСКФ – расчётная скорость клубочковой фильтрации.
Пиперациллин/тазобактам при лечении пневмоний
В соответствии с современными представлениями(и без излишней детализации), различают внебольничные и нозокомиальные (госпитальные) пневмонии. Последние диагностируют в том случае, если от момента госпитализации больного по любому поводу прошло 48 и более часов. Если пневмония развилась на 3–5-е сутки пребывания в стационаре, говорят о ранней нозокомиальной пневмонии, если более 5 суток – о поздней.
Согласно протоколу оказания помощи взрослым больным нозокомиальной пневмонией (НП), введённому в действие Приказом Министерства здравоохранения Украины № 128 от 19.03.2007 г., ПТЗ в комбинации с «антисинегнойным» фторхинолоном или аминогликозидом (и – по показаниям – антистафилококковым антибиотиком) является одним из β-лактамов выбора для лечения ранней НП с факторами риска инфицирования MDR-возбудителями и поздней НП [13].
Такой же позиции в отношении ПТЗ придерживаются американские, европейские и британские эксперты. Эмпирический выбор антибиотиков для лечения НП, согласно мнению специалистов IDSA/ATS(Американского общества инфекционистов и торакального общества), зависит от 1) наличия факторов риска смертности и 2) риска инфицирования MRSA (метициллинорезистентныеS. aureus).
При этом факторы риска смертности определяются как потребность в искусственной вентиляции лёгких вследствие пневмонии и септический шок. Американские эксперты предлагают дозировать антибиотики на основании ФК/ФД данных, а не в соответствии с информацией производителей о дозировании (слабая рекомендация, качество доказательств очень низкое), и назначать их сроком на 7 дней (на сей раз – сильная рекомендация).
Независимо от риска смертности (низкий или высокий) и количества антибиотиков (монотерапия или комбинация препаратов), первым во всех рекомендациях по эмпирической антибактериальной терапии стоит ПТЗ [14]. Хотя антибиотики сгруппированы по классам и соединяются в рекомендациях союзом «или», приоритетное положение ПТЗ не соответствует ни латинскому алфавиту, ни срокам появления препаратов на рынке, ни последовательному перечислению антибиотиков разных классов (фторхинолоны появляются внутри класса β-лактамов – между цефалоспоринами и карбапенемами).
Вряд ли такое положение ПТЗ можно рассматривать как дань традиции (пенициллин был первым антибиотиком, внедрённым в клиническую практику, поэтому изложение рекомендаций следует начинать с пенициллинов). Вероятно, при формировании перечня учитывалась не только клиническая эффективность и безопасность, но и другие обстоятельства – например, выраженность влияния на микроэкологию кишечника, риск возникновения резистентных штаммов в процессе лечения и т.д.
В действующих европейских рекомендациях по НП (подготовленных тремя европейскими профессиональными сообществами совместно с Латиноамериканской торакальной ассоциацией) ПТЗ фигурирует среди препаратов выбора для лечения больных с высоким риском инфицирования MDR-патогенами и/или если риск смертности превышает 15% [15].
Наконец, в британских рекомендациях ПТЗ в дозе по 4,5 г 3–4 раза в сут. вновь оказывается на первом месте в перечне антибиотиков для в/в введения при НП в случаях тяжёлых симптомов (например, при сепсисе) или повышенном риске резистентности. Под последним понимают позднюю НП, сопутствующее тяжёлое заболевание лёгких или иммуносупрессию, недавнее использование антибиотиков широкого спектра действия, колонизацию MDR-бактериями, недавний контакт с учреждениями здравоохранения или социальной помощи перед нынешней госпитализацией [16].
Таким образом, ПТЗ (монотерапия или в составе комбинации антибиотиков) является препаратом выбора для лечения поздних НП.
Значимость разумного использования антибиотиков существенно возросла в условиях пандемии ковид-19. В действующем в Украине протоколе по оказанию медицинской помощи для лечения коронавирусной болезни (covid-19) ПТЗ включён в перечень антибиотиков для эмпирической терапии поздней НП [17].
Объективности ради следует признать, что основное положение протокола в части лечения поздних НП (а именно – использовать комбинацию незащищённых ингибиторами цефалоспоринов IIIпоколения и макролидов) не выдерживает никакой критики и противоречит здравому смыслу (цефалоспорины разрушаются многими β-лактамазами, в том числе БЛРС, а макролиды неактивны ни в отношении представителей семейства Enterobacterales, ни неферментирующих глюкозу бактерий).
После такого утверждения логично дать ответ на вопрос: а как, собственно, следует лечить инфекции, вызванные энтеробактериями, вырабатывающими БЛРС?
Пиперациллин/тазобактам для лечения инфекций кровотока, вызванных представителями семейства Enterobacterales, вырабатывающими β-лактамазы расширенного спектра действия
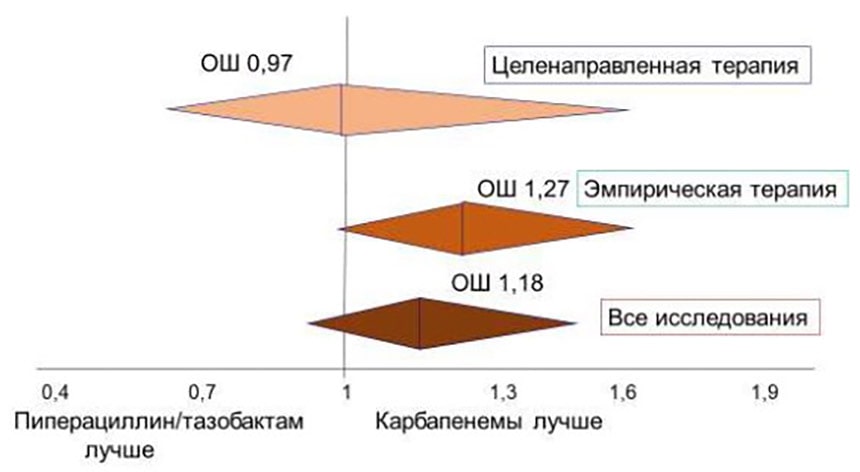
До недавнего времени были доступны данные только обсервационных исследований. Согласно результатам мета-анализа 25 подобных исследований (n=3842), опубликованных не позже июня 2017 г., защищённые β-лактамы (ПТЗ, цефоперазон/сульбактам, амоксициллин/клавуланат) не отличались от карбапенемов по влиянию на краткосрочную смертность (в течение 30 дней): отношение шансов (ОШ) 1,07 (95% ДИ 0,81–1,41).
Различия отсутствовали как в случае проведения эмпирической терапии (ОШ 1,13 (95% ДИ 0,87–1,47)), так и целенаправленной (ОШ 0,96 (95% ДИ 0,5–1,86)). Прямое сравнение ПТЗ и карбапенемов также не выявило значимых различий (рис. 5) [18]. Следует добавить, что разделение БЛРС и β-лактамаз типа AmpC при помощи молекулярного тестирования проводилось лишь в 8 из 25 исследований.
Рисунок 5. 30-дневная смертность при инфекциях кровотока, вызванных энтеробактериями – продуцентами БЛРС.
 Однако ситуация изменилась после публикации результатов первого РКИ, дизайн которого предполагал получение доказательств, что ПТЗ «не хуже» меропенема при лечении госпитализированных больных с инфекциями кровотока, вызванными E. coliи K. pneumoniae, резистентными к цефтриаксону (исследование MERINO).30-дневная смертность в группе лечения ПТЗ оказалась на 9% выше (95% ДИ 3%–15%), что позволило авторам заключить, что полученные данные не поддерживают использование ПТЗ в указанных условиях [19].
Однако ситуация изменилась после публикации результатов первого РКИ, дизайн которого предполагал получение доказательств, что ПТЗ «не хуже» меропенема при лечении госпитализированных больных с инфекциями кровотока, вызванными E. coliи K. pneumoniae, резистентными к цефтриаксону (исследование MERINO).30-дневная смертность в группе лечения ПТЗ оказалась на 9% выше (95% ДИ 3%–15%), что позволило авторам заключить, что полученные данные не поддерживают использование ПТЗ в указанных условиях [19].
Безусловно, в ходе РКИ получают самые качественные доказательства в пользу того или другого предположения, и основной вывод авторов – что карбапенемы являются препаратами выбора для лечения подобных пациентов – нет смысла подвергать сомнениям. Тем не менее, некоторые комментарии представляются уместными[20–22]:
- Дизайн исследования (открытое РКИ) предполагает знание и врачом, и пациентом, какой именно антибиотик используется, что могло повлиять на конечные результаты;
- Исследование было завершено досрочно, что не позволяет исключить возможность дисбаланса между группами сравнениями по некоторым переменным величинам;
- ПТЗ вводился в/в за 30 мин. по 4,5 г каждые 8 ч, в то время как при величинах МПК >16 мг/л требуется продлённая инфузия;
- Смертность регистрировалась, главным образом, у больных с поздними стадиями рака и зачастую не была связана с инфекцией;
- Хотя локальные (местные) лаборатории трактовали выделенные штаммы бактерий как чувствительные к ПТЗ (исследования проводились методом Е-тестов), существенная часть из них оказалась резистентной в ходе проверки результатов по методу микроразведений в бульоне.
Последнее обстоятельство связано с тем, что изоляты, которые одновременно вырабатывают БЛРС и β-лактамазы типа ОХА-1, могут трактоваться как чувствительные к ПТЗ, если их тестируют автоматическими методами или с помощью Е-тестов. Простым методом исключения продукции ОХА-1 является одновременное определение чувствительности изолята к амоксициллину/клавуланату: если изолят к нему чувствительный, то продукцию ОХА-1 можно исключить [23].
Следует добавить, что европейские (EUCAST) и американские (CLSI) критерии чувствительности энтеробактерийк ПТЗ разные: соответственно ≤ 8 и ≤ 16 мг/л. Если результаты исследования MERINO проанализировать с исключением штаммов с МПК пиперациллина/тазобактама>16 и > 8 мг/л по методу микроразведений в бульоне, статистически значимая разница в смертности между группами ПТЗ и меропенема исчезает: соответственно 5% (95% ДИ -1%–11%) и 4% (95% ДИ -2%–11%) [22].
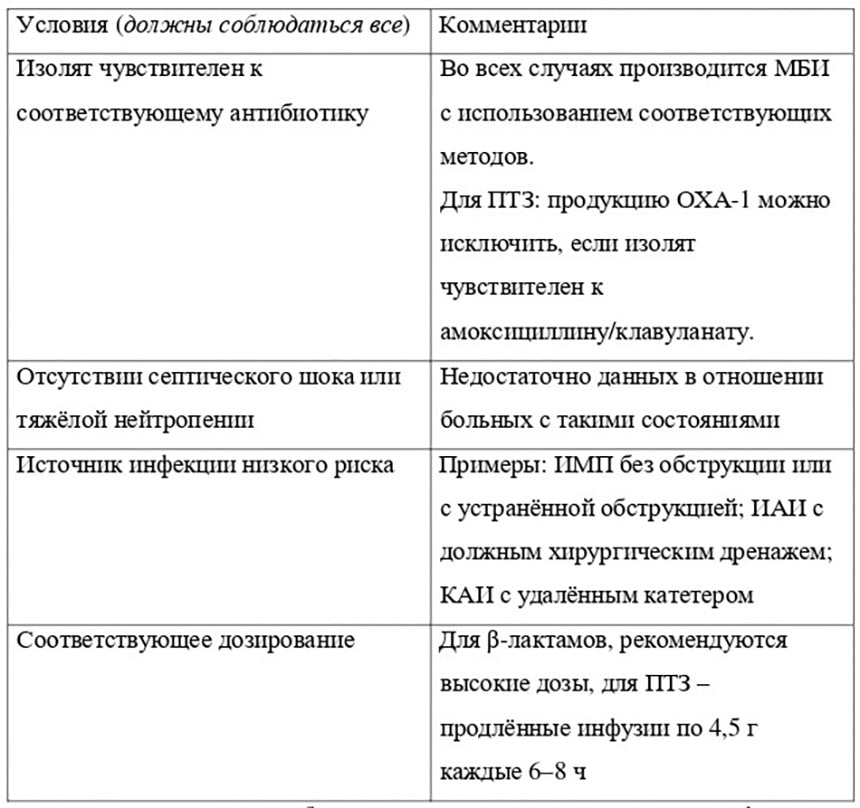
Изложенное, не отменяя приоритет карбапенемов для лечения инфекций, вызванных резистентными к цефтриаксонуэнтеробактериями, позволяет очертить возможности использования некарбапенемных антибиотиков (в том числе ПТЗ) в терапии подобных инфекций (табл. 1) [23].
Таблица 1. Возможности использования некарбапенемных антибиотиков для лечения инфекций, вызванных представителями семейства Enterobacterales, резистентными к цефтриаксону
Пиперациллин/тазобактам для лечения инфекций кожи и мягких тканей
Высокая эффективность ПТЗ при осложнённых инфекциях кожи и мягких тканей (ИКМТ) была неоднократно подтверждена в сравнительных РКИ с эртапенемом, моксифлоксацином и другими антибиотиками [24]. В американских рекомендациях по лечению ИКМТ комбинация ПТЗ и ванкомицина рассматривается в качестве первого выбора при эмпирической терапии тяжёлых негнойных инфекций (например, некротизирующего фасциита и целлюлита).
ПТЗ рекомендуется также и при инфекциях в области хирургического вмешательства, укушенных ранах [25], для эмпирической терапии тяжелых случаев инфекций диабетической стопы, сопровождающихся системными симптомами (например, гипотензией, нарушением сознания, рвотой) или метаболическими расстройствами (такими как ацидоз, тяжёлая гипергликемия, появление азотемии) [26].
В свою очередь, британские эксперты предлагают использовать ПТЗ в/в по 4,5 г 3–4 раза в сут. при среднетяжёлых и тяжёлых инфекциях диабетической стопы у взрослых в случаях идентификации или подозрения на инфицирование P. aeruginosa[27].Примечания: МБИ – микробиологические исследования; ИМП – инфекции мочевых путей; ИАИ – интраабдоминальные инфекции; КАИ – катетер-ассоциированные инфекции.
Чувствительность возбудителей раневой инфекции к пиперациллину/тазобактаму в Украине была изучена в исследовании АУРА [28].Материал для микробиологических исследований получали из ран при инфекциях кожи и мягких тканей, интраабдоминальных инфекциях, инфекциях костей и суставов. Из 800 выделенных штаммов 453 (56,6%) были представлены грамположительными микроорганизмами, 344 (43,0%) – грамотрицательными, 3 (0,4%) – грибами рода Candida.
Доля Staphylococcusspp. среди всех выделенных штаммов составила 25,8%, причём 35% из них оказались нечувствительными к метициллину. Почти все β-лактамные антибиотики, включая ПТЗ, неактивны в отношении метициллинорезистентных Staphylococcusspp., в то время как чувствительные к метициллину штаммы сохраняют к ним 100% чувствительность (либо очень близкую к 100%). Чувствительность Streptococcusspp. и Enterococcusfaecalis к ПТЗ оказалась высокой и колебалась в пределах 90–92%.
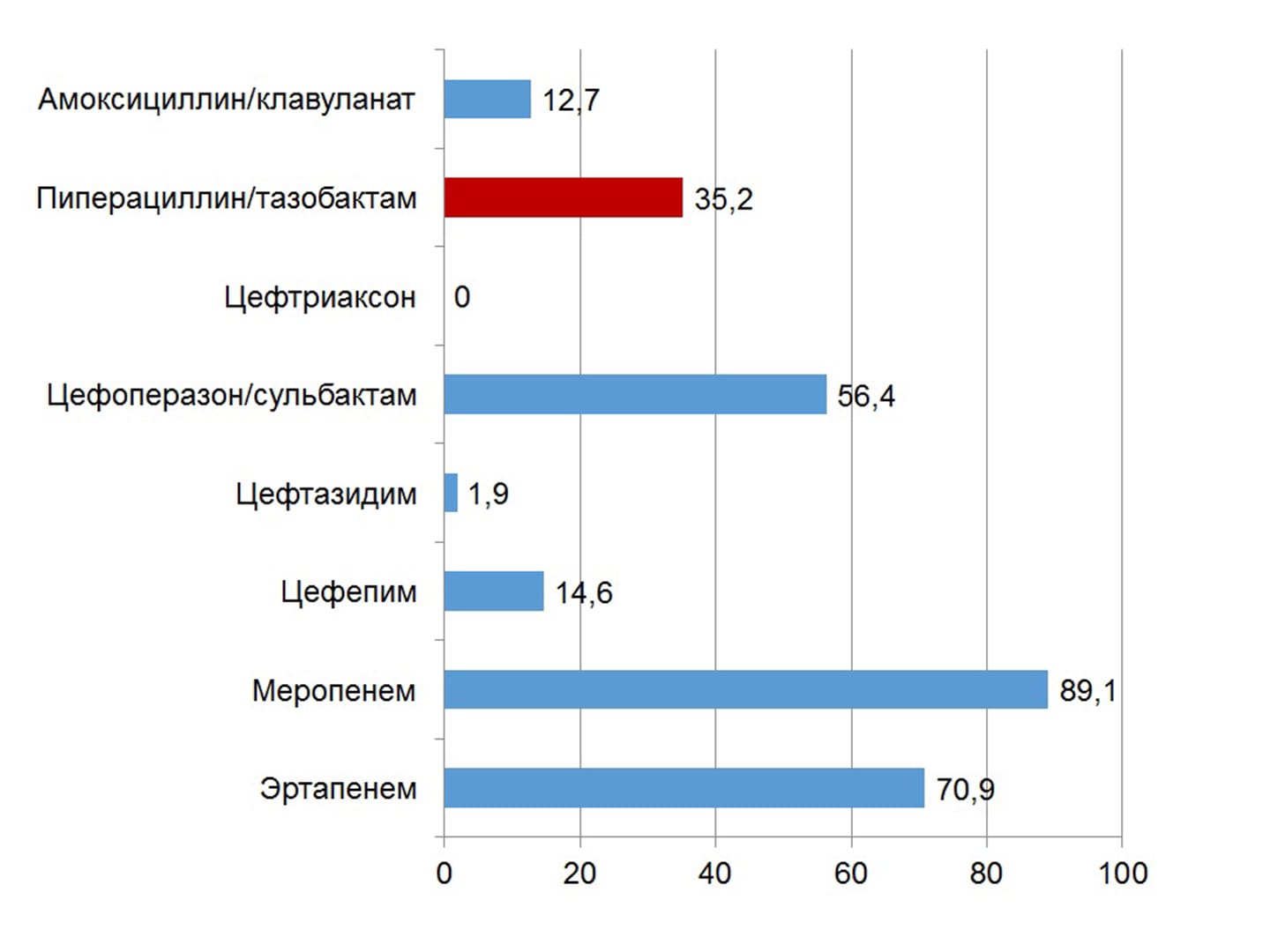
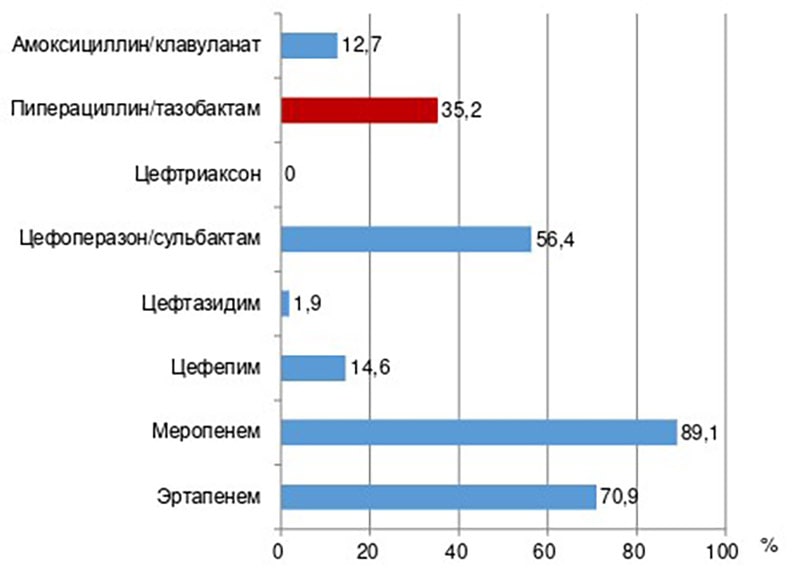
Среди представителей семейства Enterobacteralesсамая высокая чувствительность к ПТЗ выявлена у Proteusspp.(97,4%), самая низкая – у Klebsiellaspp. (5%). Около трети (31,6%) штаммов энтеробактерий вырабатывали БЛРС, их чувствительность к β-лактамам представлена на рис. 6.
Рисунок 6. Чувствительность к β-лактамам всех штаммов Enterobacterales, которые вырабатывали БЛРС (E. coli+ Klebsiellaspp. + Proteusspp. + E. cloacae+ M. morganii, n=55)
 Чувствительность P. aeruginosaк ПТЗ низкая (20,6%), как, впрочем, и к другим β-лактамам (к меропенему – 24%, к цефепиму – 25,7%).
Чувствительность P. aeruginosaк ПТЗ низкая (20,6%), как, впрочем, и к другим β-лактамам (к меропенему – 24%, к цефепиму – 25,7%).
В целом, в Украине у большинства возбудителей раневой инфекции установлена высокая чувствительность к ПТЗ. Исключение составляют Klebsiellaspp. и неферментирующие бактерии. В подобных случаях, а также при высоком риске инфицирования энтеробактериями, продуцирующими БЛРС, ПТЗ лучше использовать в комбинации с антибиотиками других классов.
Возможности использования пиперациллина/тазобактама у больных с аллергическими реакциями на пенициллины в анамнезе
В рутинной клинической практике при наличии анамнестических указаний на аллергическую реакцию (АР) на тот или иной антибиотик в случае надобности используется альтернативный препарат. У больных с аллергией на пенициллины ограничения на использование зачастую распространяются на все β-лактамные антибиотики, прежде всего из-за опасений перекрестной реактивности.
На самом деле, следует иметь в виду, что 1) повышенная чувствительность к антибиотикам стихает с течением времени; 2) перекрестная реактивность даже в пределах одного класса антибиотиков может отсутствовать или встречается редко; 3) применение альтернативного антибиотика ассоциируется с увеличением расходов на лечение, возрастанием продолжительности пребывания в стационаре и повышенным риском инфицирования резистентными микроорганизмами, такими как ванкомицинорезистентные энтерококки, Clostridioides difficile и MRSA [29].
Перекрестная реактивность между пенициллинами чаще всего обусловлена наличием идентичной или подобной R1-боковой цепи и крайне редко – общего β-лактамного кольца. Пенициллин не имеет ни общей, ни подобной R1-боковой цепи с другими пенициллинами, поэтому вероятность перекрестного реагирования с другими антибиотиками этого класса чрезвычайно мала. Напротив, у аминопенициллинов (амоксициллин, ампициллин) и пиперациллина имеются подобные R1-боковые цепи [30], в связи с чем при анамнестических указаниях на АР на любой из аминопенициллинов использовать ПТЗ до проведения аллергологического тестирования небезопасно.
Следует избегать использования ПТЗ (до проведения аллергологического тестирования) у больных с АР в анамнезе на цефалоспориныI поколения для приема внутрь цефадроксил (подобнаяR1-боковая цепь с пиперациллином) и цефалексин, а также цефалоспорин II поколения для приема внутрь цефаклор (в двух последних случаях – подобнаяR1-боковая цепь с пиперациллином).
С другой стороны, если пациент с анамнестическими указаниями на АР на перечисленные цефалоспориныпереносит любой из пенициллиновс идентичной или подобной R1-боковой цепью, избегать использования других пенициллинов (включая ПТЗ) незачем – даже если больной (больная) продолжает избегать применения цефалоспоринов [30, 31].
Таким образом, ПТЗ может использоваться не только у больных с АР на пенициллин в анамнезе, но и у лиц с анамнестическими указаниями на АР на цефалоспорины III-IV поколений и карбапенемы. Предварительное аллергологическое тестирование показано в случаях задокументированных в прошлом реакций на аминопенициллины (ампициллин, амоксициллин) или аминоцефалоспорины (цефалексин, цефадроксил, цефаклор).
Заключение
Пиперациллин/тазобактам является общепризнанным антибиотиком выбора для лечения тяжёлых инфекций, прежде всего в хирургических отделениях и отделениях реанимации и интенсивной терапии. Область клинического использования ПТЗ включает в себя интраабдоминальные инфекции, инфекции кожи и мягких тканей, поздние нозокомиальные пневмонии, инфекции других локализаций. Появление на рынке Украины первого отечественного ПТЗ («РЕФЕКС» производства компании «Юрия-фарм») существенно расширит возможности врачей Украины по оказанию населению адекватной медицинской помощи.
Авторы:
И.Г. Березняков, Харьковская медицинская академия последипломного образования.
Литература:
- https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/050684s88s89s90_050750s37s38s39lbl.pdf. Посещение 07.12.2021 г.
- Craig W.A. Basic pharmacodynamics of antibacterials with clinical applications to the use of beta-lactams, glycopeptides, and linezolid. Infect.Dis.Clin. North Am. 2003; 17:479–501.
- Drusano G.L. Antimicrobial pharmacodynamics: critical interactions of ‘bug and drug’. Nat.Rev.Microbiol. 2004; 2:289–300.
- McKinnon P.S., Paladino J.A., Schentag J.J. Evaluation of area under the inhibitory curve (AUIC) and time above the minimum inhibitory concentration (T > MIC) as predictors of outcome for cefepime and ceftazidime in serious bacterial infections. Int. J.Antimicrob. Agents 2008; 31:345–351.
- Abdul-Aziz M.H., Lipman J., Mouton J.W., et al. Applying pharmacokinetic/pharmacodynamic principles in critically ill patients: optimizing efficacy and reducing resistance development. Semin.Respir. Crit. Care Med. 2015;36(1):136–153.
- Roberts J.A., Abdul-Aziz M.H., Lipman J., et al. Individualised antibiotic dosing for patients who are critically ill: challenges and potential solutions. Lancet Infect. Dis. 2014;14 (6):498–509.
- Imani S., Buscher H., Day R., et al. An evaluation of risk factors to predict target concentration non-attainment in critically ill patients prior to empiric β-lactam therapy. Eur. J. Clin. Microbiol. Infect. Dis. 2018; 37 (11): 2171–2175.
- Alobaid A.S., Brinkmann A., Frey O.R., et al. What is the effect of obesity on piperacillin and meropenem trough concentrations in critically ill patients? J.Antimicrob.Chemother. 2016;71(3):696–702.
- Evans L., Rhodes A., Alhazzani W., et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intens. Care Med. https://doi.org/10.1007/s00134-021-06506-y.
- Fawaz S., Barton S., Nabhani-Gebara S. Comparing clinical outcomes of piperacillin-tazobactam administration and dosage strategies in critically ill adult patients: a systematic review and metaanalysis. BMC Infect. Dis. 2020; 20: 430.
- Yang H., Cui X., Ma Z., et al. Clinical outcomes with alternative dosing strategies for piperacillin/tazobactam: a systematic review and meta-analysis. PLoS One. 2015; 19 (2): 274–89.
- Abdulla A., Ewoldt T.M.J., Purmer I.M., et al. A narrative review of predictors for β-lactam antibiotic exposure during empirical treatment in critically ill patient. Expert Opin. Drug Metabol. Toxicol. 2021; 17 (4): 359-368.
- Протоколнаданнямедичноїдопомогихворимнанегоспітальнутанозокоміальну (госпітальну) пневмоніюудорослихосіб: етіологія, патогенез, класифікація, діагностика, антибактеріальнатерапія. Затверджений наказом МОЗ Українивід 19 березня 2007 р. № 128. Доступно за адресою: http://www.ifp.kiev.ua/doc/staff/MOZ-128-19032007.pdf.
- Kalil A.C., Metersky M.L., Klompas M., et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin. Infect. Dis. 2016; 63 (5): e61–111.
- Torres A., Niederman M.S., Chastre J., et al. International ERS/ESICM/ESCMID/ALAT guidelines for the management of hospital-acquired pneumonia and ventilator-associated pneumonia.Eur.Respir. J. 2017; 50: 1700582.
- Pneumonia (hospital-acquired): antimicrobial prescribing. NICEguideline [NG139]. Доступно по адресу: https://www.nice.org.uk/guidance/ng139
- Протокол «надання медичної допомоги для лікування коронавірусної хвороби (covid-19)». Оновлений 11.11.2021 р. Доступно за адресою:https://moz.gov.ua/article/ministry—mandates/nakaz—moz—ukraini—vid-11112021—2495-pro—vnesennja—zmin—do—protokolu—nadannja—medichnoi—dopomogi—dlja—likuvannja—koronavirusnoi—hvorobi—covid-19
- SfeirM.M., AskinG., ChristosP. Beta-lactam/beta-lactamase inhibitors versus carbapenem for bloodstream infections due to extended-spectrum beta-lactamase-producing Enterobacteriaceae: systematic review and meta-analysis. Int. J. Antimicrob. Agents. 2018;52(5):554-570.
- Harris P.N.A., Tambyah P.A., Lye D.C., et al. Effect of piperacillin-tazobactam vs meropenem on 30-daymortality for patients with E coli or Klebsiellapneumoniaebloodstream infection and ceftriaxone resistance. A randomized clinical trial. JAMA 2018; 320: 984–94.
- Andersen M.G., Thorsted A., Storgaard M., et al. Population pharmacokinetics of piperacillin in sepsis patients: should alternative dosingstrategies be considered? Antimicrob. Agents Chemother. 2018; 62: e02306–17.
- Pitout J.D., Le P., Church D.L., et al. Antimicrobial susceptibility of well-characterisedmultiresistant CTX-M-producing Escherichia coli: failure of automated systems to detect resistance to piperacillin/tazobactam. Int. J. Antimicrob. Agents 2008; 32: 333–8.
- Henderson A., Paterson D.L., Chatfield M.D., et al. Association between minimum inhibitory concentration, β-lactamase genes and mortality for patientstreated with piperacillin/tazobactam or meropenem from the MERINO study.Clin. Infect. Dis. 2020; doi: 10.1093/cid/ciaa1479
- Rodríguez-Baño J., Gutiérrez-Gutiérrez B., Pascual A. CON: Carbapenems are NOT necessary for all infections caused by ceftriaxone-resistant Enterobacterales. JAC Antimicrob. Resist. 2021. doi:10.1093/jacamr/dlaa112
- Takimoto K., Wang Q., Suzuki D., et al. Clinical efficacy of piperacillin/tazobactam in the treatment of complicated skin and soft tissue infections. Expert Opinion Pharmacother., 2017. doi:10.1080/14656566.2017.1341491
- Stevens D.L., Bisno A.L., Chambers H.F., et al. Practice guidelines for the diagnosis andmanagement of skin and soft tissue infections: 2014 update by the Infectious Diseases Society ofAmerica. Clin. Infect. Dis. 2014;59:e10–52.
- Lipsky B.A., Berendt A.R., Cornia P.B., et al. 2012 Infectious Diseases Society of Americaclinical practice guideline for the diagnosis and treatment of diabetic foot infections. Clin. Infect .Dis. 2012;54:e132–73.
- Diabetic foot problems: prevention and management. NICE guideline. Last updated 11 October 2019. Доступно по адресу: www.nice.org.uk/guidance/ng19
- Березняков І.Г. Стан антибіотикорезистентності в Україні: результати дослідження АУРА. Здоров’я України ХХІ вік. 2020; тематичний номер (4): 31-34.; тематичний номер (5): 21-23.
- Macy E., Contreras R. Health care use and serious infection prevalence associated with penicillin “allergy” in hospitalized patients: a cohort study. J. Allergy Clin. Immunol. 2014; 133: 790-6.
- Zagursky R.J., Pichichero M.E. Cross-reactivity in β-lactam allergy J. Allergy Clin. Immunol. Pract. 2018; 6: 72-81.e1.
- Березняков И.Г. Аллергические реакции на антибиотики. Харьков: ГО УАДВА, 2021. – 58 с.






