Досвід застосування Дексмедетомідину для інтраопераційної анальгоседації при проведенні офтальмологічних операцій
Мета дослідження: оцінити якість і безпечність седації при проведенні анестезіологічного забезпечення при амбулаторних операціях в офтальмохірургії, застосовуючи безперервну внутрішньовенну інфузію Дексмедетомідину.
Матеріали і методи: досліджувану групу склали 40 пацієнтів, пацієнти були рандомізовані на групи за віком: дорослі пацієнти (18–64 роки), літні люди (65- 75 років), старечий вік (76 років); за статтю: чоловіки (14), жінки (26). Проводилась оцінка фізичного статусу пацієнтів за шкалою ASA та оцінка динаміки вегетативної активності за вегетативним індексом Кердо. Оцінка рівня седації проводилась за шкалою ажитації-седації Річмонда RASS. Використовувавали дексмедетомідин (Кванадекс) вітчизняного виробника Юрія-Фарм.
Результати дослідження. Було показано, що різниця в частоті несприятливих наслідків призначення Дексмедетомідину наглядно підтверджує необхідність корекції дози Дексмедетомідину залежно від стану автономної нервової системи (АНС). Використання Дексмедетомідину згідно з рекомендаціями дозволяло досягти безпечного рівня седації й усунення побічних ефектів в амбулаторній офтальмохірургії.
Висновки:
- В/в безперервна інфузія Дексмедетомідину забезпечує ефективний рівень седації офтальмологічних пацієнтів при амбулаторних операціях, зберігаючи при цьому контакт пацієнта з хірургом.
- Безпека підтверджується низьким рівнем критичних інцидентів, відсутньою депресією дихання при цільовому рівні седації.
- Прохідність верхніх дихальних шляхів була кращою порівняно з попереднім досвідом використання Пропофолу в якості єдиного седативного засобу.
Ключові слова: анальгоседація, дексмедетомідин, автономна нервова система.
Актуальність
Питання про доцільність і безпеку використання Дексмедетомідину залишається відкритим не лише у нас, але й за кордоном.
Це пов’язано з тим, що застосування Дексмедетомідину визначає особливі вимоги до седації. Пов’язано з тим, що маємо відносно коротку тривалість маніпуляції, високу рефлексогенність і нам потрібно створити умови особливого «хірургічного комфорту».
Хірургу необхідна не лише седація пацієнта (щоб він не заважав працювати), але необхідний контакт (щоб пацієнт міг відповідати на запитання, виконувати елементарні команди хірурга під час оперативного втручання). Таким чином, нам необхідний «ідеальний» препарат (засіб) для седації, який би мав на меті:
- Передбачувану фармакокінетику і фармакодинаміку.
- Відносно швидке відновлення когнітивних і фізичних функцій.
- І що дуже важливо в даній ситуації — збереження контакту пацієнта з хірургом.
Щоб наблизитись максимально до цієї мети, прийняте рішення використовувати препарат — Дексмедетомідин.
Дексмедетомідин — високоселективний агоніст альфа-2-адренорецепторів з широким спектром фармакологічних властивостей.
Мета дослідження
Покращення якості анестезіологічного забезпечення за рахунок оптимізації седації при виконанні амбулаторних офтальмологічних операцій. Основним завданням роботи була оцінка ефективності та безпечності седації при проведенні офтальмологічних операцій, застосовуючи безперервну внутрішньовенну інфузію Дексмедетомідину.
Фармакологічна дія препарату
Дексмедетомідин є селективним агоністом альфа- 2-адренорецепторів з широким спектром фармакологічних властивостей. Здійснює симпатолітичний ефект за рахунок зниження виділення норадреналіну в симпатичних нервових закінченнях. Седативні ефекти зумовлені зниженням збудження блакитної плями, основного норадренергічного ядра, що знаходиться у стовбурі мозку. Також Дексмедетомідин має помірний знеболюючий і анестезуючий ефект. Серцево-судинні ефекти залежать від дози. При нижчих швидкостях інфузії переважають центральні ефекти, що приводять до зниження частоти серцевих скорочень і артеріального тиску. При вищих дозах переважають периферичні судинозвужуючі ефекти, які приводять до збільшення системного судинного опору та артеріального тиску, в той час як брадикардичний ефект додатково підкреслюється. Дексмедетомідин практично не чинить пригнічувальної дії на дихальну систему при застосуванні у якості монотерапії здоровим пацієнтам. Дексмедетомідин значно знижує потребу в додаткових седативних засобах (опіоїди, Пропофол, мідазолам).
Фармакокінетика Дексмедетомідину є лінійною в діапазоні доз від 0,2 до 1,4 мкг/кг/год, він не накопичується при лікуванні тривалістю до 14 днів. Дексмедетомідин виводиться з організму в результаті обширного обміну речовин у печінці. Ніякої серйозної фармакокінетичної відмінності залежно від статі і віку не спостерігалось.
Нас зацікавив його седативний ефект, який забезпечує стан, схожий на фізіологічний сон, і стан, який забезпечує седацію в кооперації з пацієнтом.
Згідно зі спільною заявою, що опублікована ASA і Американською асоціацією анестезіологів- медсестер (AANA), 20 препаратів, таких як Пропофол, вимагають особливої уваги через потенціал до швидких змін в глибині седативного/ анестезуючого ефекту засобу; це може призвести до втрати або зниження захисних рефлексів пацієнта (тому важливий контроль дихальних шляхів/ дихання, кровообігу). Далі в заяві говориться: «Усілякий раз, коли Пропофол використовується для седації/ анестезії, його повинні призначати особи, що пройшли підготовку з загальної анестезії, які не беруть участь одночасно в цих хірургічних або діагностичних процедурах.
Для оцінки динаміки стану вегетативної активності, а точніше, її впливу на серцево-судинну систему, використовували вегетативний індекс Кердо (ІК). ІК = (1-АТ діаст./ЧСС) × 100. За стан вегетативної рівноваги (ейтонія) було прийнято значення ІК в межах 0+-10. Зміщення індекса в бік позитивних значень (понад +10) розцінювали як переважання симпатичних впливів на серцево-судинну систему. Зміщення ІК в бік негативних значень (менше -10) розцінювали як переважання парасимпатичних впливів. Атропін призначали в премедикацію у пацієнтів, у яких переважає активність парасимпатичної нервової системи. Призначення стандартної дози Дексмедетомідину в осіб із підвищеним тонусом парасимпатичної нервової системи, супроводжувалось зниженням серцевого індексу (СІ) у вигляді гіпотонії (дисфункція шлуночків). Різниця в частоті несприятливих наслідків призначення Дексмедетомідину наглядно підтверджує необхідність корекції дози Дексмедетомідину залежно від стану автономної нервової системи (АНС). Поєднане використання холінолітичної премедикації і зменшення дози Дексмедетомідину у пацієнтів, у яких спостерігалося домінування парасимпатичної нервової системи, могло не призводити до відновлення вегетативної рівноваги, але принаймні не посилювало дисфункцію.
Тактика анестезії, яка враховує стан АНС, дозволяє вигідно уникати зниження СІ і розвитку стану гіпоперфузії у пацієнтів з початковою перевагою парасимпатичної нервової системи. Досягнення необхідних значень СІ на фоні зниження ЧСС в цих випадках відбувається за рахунок зниження судинного тонусу і збільшення СІ.
Матеріали і методи
Досліджувану групу склали 40 пацієнтів, пацієнти були рандомізовані на групи за віком: дорослі пацієнти (18–64 роки), літні люди (65–75 років), старечий вік (76 років); за статтю: чоловіки (14), жінки (26). Пацієнтам проводились оперативні втручання з приводу: блефаропластики, усунення птозу, факоемульсифікації катаракти (ФЕК), усунення косоокості, дакріоцисториностомії, халязіону, енуклеації, ксантелазми, птеригіуму з пересадкою кон’юнктиви (табл. 1). У залучених пацієнтів не було гемодинамічно значимих порушень з боку серцево-судинної системи і вони були компенсовані по супутній патології.
У всіх пацієнтів отримано інформовану згоду на проведення діагностики та лікування, у разі необхідності — на оперативне втручання та аналгоседацію з використанням Дексмедетомідину для медикаментозної седації (форма № 003-6/о).
До досліджуваної групи не включались ургентні пацієнти, пацієнти з гемодинамічно значимими порушеннями з боку серцево-судинної системи (брадикардія з ЧСС менше 45 за хвилину, порушення ритму серця по типу миготливої аритмії), при наявності супутньої патології в стадії декомпенсації та ризику анестезіологічного забезпечення ASA 4–5, пацієнти, що відмовились від проведення седації з Дексмедетомідином.
Результати
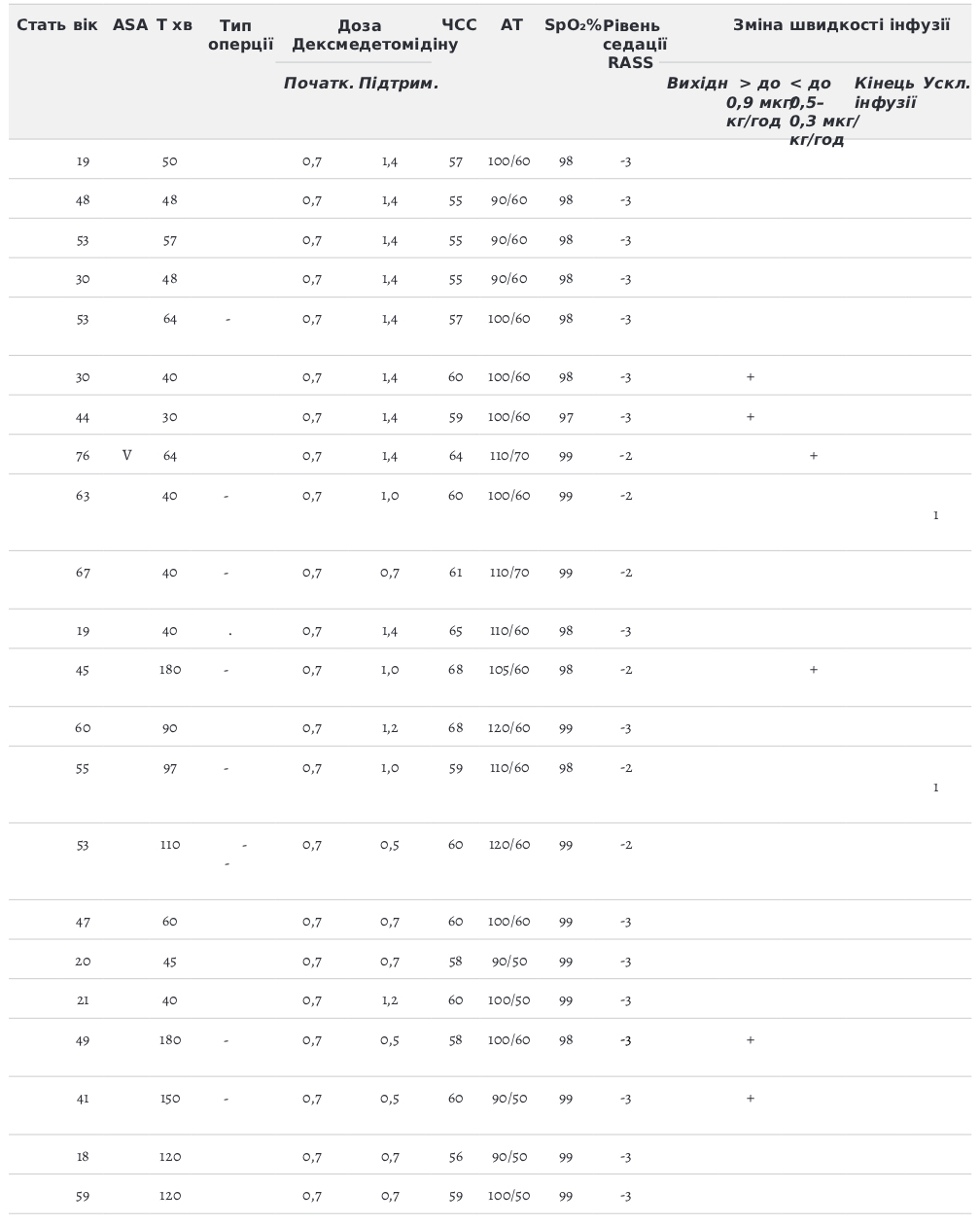
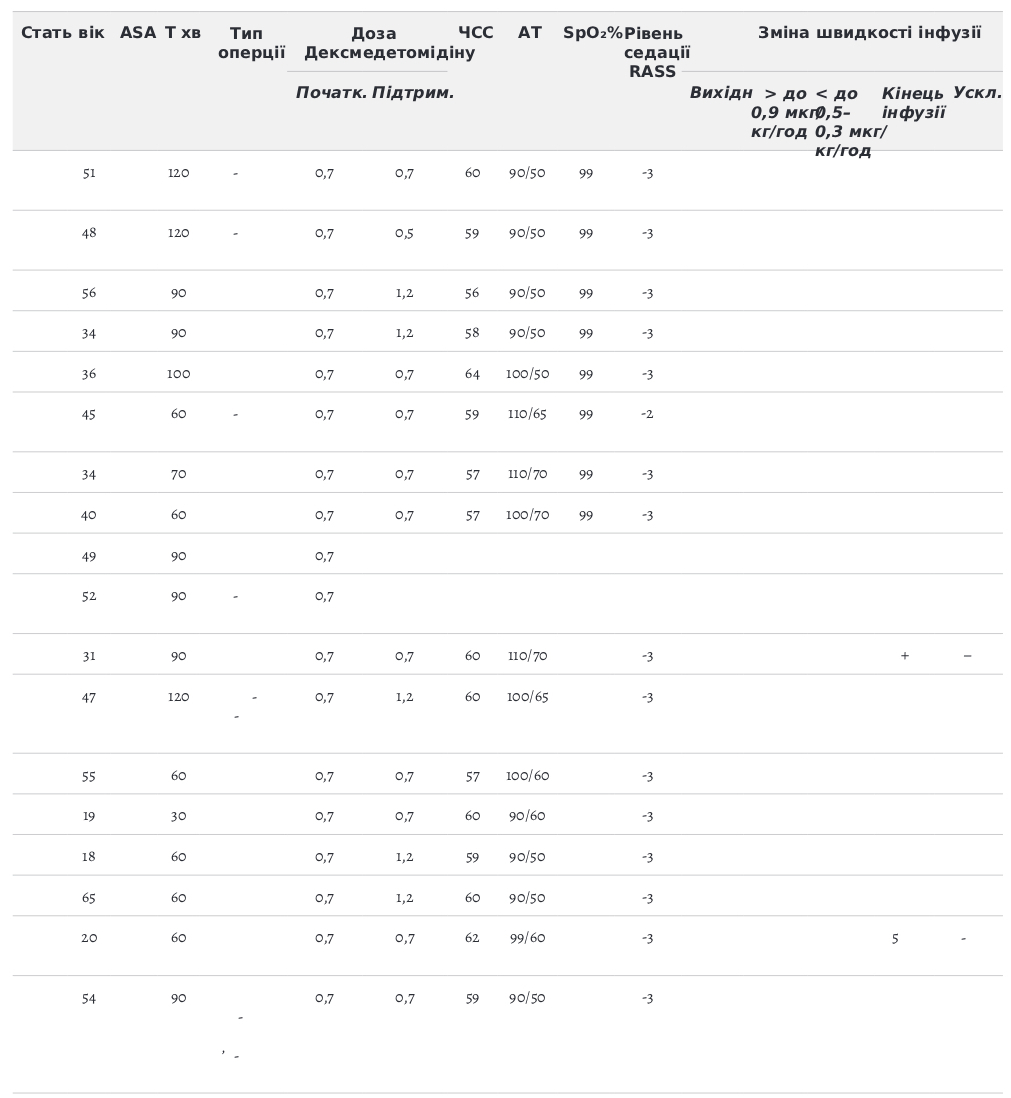
Ми оцінювали фізичний статус пацієнтів по ASA (табл.1): ASA 1 — 70 % (28 пацієнт), ASA 2 — 27,5 % (11 пацієнтів), ASA 4 — 2,5 % (1 пацієнт).
Середня тривалість операції складала 78,28 хвилин. Навантажувальної дози Дексмедетомідину не було. Використання препарату згідно з рекомендаціями. Початкова швидкість внутрішньовенної інфузії 0,7 мкг/кг год корегувалась у межах 0,3–0,9 мкг/кг год, для досягнення бажаного рівня седації 2–3 за шкалою RASS і усунення побічних ефектів.
Здійснювався моніторинг безпеки седації Дексмедетомідину: ЕКГ-моніторинг, ЧСС, АТ (неінвазивно), SpO2, пульсоксиметрія, ЧД.
Рівень седації та ажитації за шкалою Річмонда (RASS). Цільове значення -2; -3. Середній час початку седативного ефекту 6–10 хвилин.
Причини зміни швидкості інфузії Підвищення швидкості до 0,9 мкг/кг/год введення Дексмедетомідину проводилось для досягнення оптимального рівня седації, тобто доза препарату 0,7 мкг/кг/год не давала достатнього рівня седації -2;-3. Ми збільшували дозу до 0,9 мкг/кг/год і ніяких гемодинамічних порушень не спостерігалось. Зниження швидкості інфузії проводили, коли ми перевищували рівень седації до -4 RASS або коли виникали зниження АТ, брадикардія (оборотна). Припиняли інфузію Дексмедетомідину, коли виникала прогресуюча синусова брадикардія. Всі брадикардії піддавались корекції кількома шляхами:
- Зниженням дози.
- Зниженням швидкості інфузії;.
- Припиненням уведення препарату.
- Вводився Атропін 0,15 мг/кг.
Гіпотонія до 90/50 мм.рт.ст. оборотна, що не потребувала корекції (лише 0,3 мкг/кг/год, без вазопресорів). Депресії дихання не спостерігалось (SpO2 вище 94 %), частота дихання 14–17 за хвилину. Комфорт пацієнта і хірурга характеризувався як відмінно і задовільно, пацієнт відповідає на запитання хірурга і співпрацює з ним.
Час до одужання після використання Дексмедетомідину складав приблизно 60 хвилин, після чого пацієнти були виписані на опіку третьої сторони.
Табл. 1. Характеристика хворих, яким виконано офтальмологічну операцію з седацією Дексмедетомідіном
Початковий рівень:
- збільшення дози пацієнтам без гемодинамічних порушень 0,9 мкг/кг/год;
- зменшення дози до 0,5–0,3 мкг/кг/год;
- інфузія зупинялась.
0,7 мкг/кг/год — оптимальний рівень седації.
Автори:
- Ходаківський Максим Анатолійович. Вінницький національний медичний університет ім. М. І. Пирогова, Україна.
- Міськова Марія Анатоліївна. Військово-медичний клінічний центр Центрального регіону, Україна.
- Нахимчук Анна Павлівлівна. Українськa військово-медична академія, Україна.
Висновки:
- В/в безперервна інфузія Дексмедетомідину забезпечує ефективний рівень седації офтальмологічних пацієнтів при амбулаторних операціях, зберігаючи при цьому контакт пацієнта з хірургом.
- Безпека підтверджується низьким рівнем критичних інцидентів, відсутньою депресією дихання при цільовому рівні седації.
- Прохідність верхніх дихальних шляхів була кращою порівняно з попереднім досвідом із Пропофолом в якості єдиного седативного засобу.
Впровадження дексмедетомідину в українську клінічну практику отримало новий поштовх із появою першого вітчизняного препарату — Кванадекс (ТОВ «Юрія-Фарм») у 2020 році. З того часу Кванадекс використовується як у відділеннях інтенсивної терапії, так і для седації під час оперативних втручань під регіонарною анестезією. Однак його потенціал не обмежується лише седацією під час регіонарної анестезії та у ВІТ. Виходячи з досвіду, відображеному в даній статті, Кванадекс зарекомендував себе як ефективний та безпечний засіб для седації під час офтальмологічних процедур.
Література:
- Annex summary of product characteristics dexdor. Available from: ec.europa.eu/health/documents/community-register/2017/20171208139366/anx_139366_en.pdf
- Gerald O’Daniel, Patrick T. Shanahan. Dexmedetomidine: A New α-Agonist Anesthetic Agent for Facial Rejuvenation Surgery. Aesthetic Surgery Journal. 2006;26(1):35–40. doi:10.1016/j. asj.2005.10.003. Available from: aes.sagepub.com/content/26/1/35
- Amir H. Taghinia, Fred E. Shapiro, Sumner A. Slavin. Dexmedetomidine in Aesthetic Facial Surgery: Improving Anesthetic Safety and Efficacy. Plastic and Reconstructive Surgery. January 2008;121(1):269–276. doi:10.1097/01. prs.0000293879.25009.8d. Available from: journals.lww.com/plasreconsurg
- Fred E. Shapiro. Anesthesia for outpatient cosmetic surgery. Current Opinion in Anaesthesiology. 2008;21(6):704–710. doi:10.1097/ACO.0b013 e328315a6ac
- Nasreen F, Bano S, Khan RM, Hasan SA. Dexmedetomidine used to provide hypotensive anesthesia during middle ear surgery. Indian Journal of Otolaryngology and Head & Neck Surgery. 2009;61(3):205–207. doi:10.1007/s12070–009–0070-y
- Yoo J H, Kim S I, Cho A, Lee S J, Sun H J, Cho H B, Lee D R. The effect of dexmedetomidine sedation on patient and surgeon satisfaction during retinal surgery under sub-Tenon’s anesthesia: a randomized controlled trial. Korean Journal of Anesthesiology. 2015 Oct;68(5):442–448. doi:10.4097/ kjae.2015.68.5.442. Available from: PubMed
- De Nucci A, Scialdone A, Lando G, Monaco G, Cacioppo V, Davies S C, Casalino G, Gemma M. Effectiveness and safety of intravenous dexmedetomidine sedation for ophthalmic surgery under regional anesthesia. European Journal of Ophthalmology. 2022 Sep;32(5):2598–2603. doi:10.1177/11206721211059013. Available from: PubMed
- Kumar C M, Chua A W Y, Imani F, Sehat Kashani S. Practical considerations for dexmedetomidine sedation in adult cataract surgery under local/ regional anesthesia: a narrative review. Anesthesiology and Pain Medicine. 2021;11(1):e112424. doi:10.5812/aapm.112424
- Jones J H, Aldwinckle R. Perioperative dexmedetomidine for outpatient cataract surgery: a systematic review. BMC Anesthesiology. 2020;20:75. doi:10.1186/s12871–020–00994–0
- Ayoglu H, et al. Dexmedetomidine sedation during cataract surgery under peribulbar block. British Journal of Anaesthesia. 2007;99(3):448–451. doi:10.1093/bja/aem18






