L-аргинин в норме и патологии
Резюме. L-аргинин — условно незаменимая аминокислота, являющаяся клеточным регулятором многих жизненно важных функций организма. Он участвует в регуляции тонуса гладкомышечного компонента стенки сосудов, бронхов, кишечника. L-аргинин является субстратом для синтазы оксида азота (NOS), которая продуцирует оксид азота (NO). NO, продуцируемый в эндотелии сосудов, отвечает за релаксацию гладких мышц и необходим для снижения артериального давления. L-аргинин имеет высокий функциональный приоритет в продукции NO и, следовательно, в физиологии сердечно-сосудистой и цереброваскулярной систем. L-аргинин может уменьшать ожирение, снижать артериальное давление, подавлять окислительные процессы и нормализовать эндотелиальную дисфункцию, способствуя ремиссии при диабете 2-го типа.
L-аргинин также используется клетками иммунной системы, может снижать уровень инфицирования, особенно при нарушении иммунной функции. L-аргинин замедляет старение, ингибирует агрегацию тромбоцитов, регулирует множественные метаболические пути, связанные с метаболизмом жирных кислот, глюкозы, аминокислот и белков. Поэтому следует учитывать большой терапевтический потенциал L-аргинина и продолжать изучение возможностей его использования в качестве перспективного препарата при прогрессировании сосудистой дисфункции, связанной со старением, диабетом и сердечно-сосудистыми заболеваниями.
Ключевые слова: L-аргинин, оксид азота, диабет, сердечно-сосудистая система, ожирение, цереброваскулярная система, иммунная система, агрегация тромбоцитов.
Общие сведения
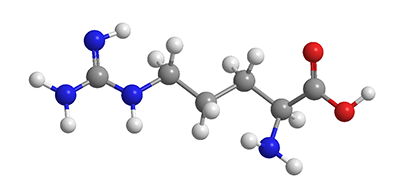
L-аргинин (2-амино-5-гуанидиновалериановая кислота) — условно незаменимая аминокислота, которая является разносторонним и активным клеточным регулятором многих жизненно важных функций организма. Аргинин является ключевым метаболитом на конечном этапе белкового и других видов обмена азотсодержащих соединений, а также играет роль незаменимого компонента важнейших регуляторных систем человека и других млекопитающих. Без его участия невозможны системная и локальная регуляция тонуса гладкомышечного компонента стенки сосудов, бронхов, кишечника. Аргинин обеспечивает эффективность лизосомально-килинговой системы фагоцитов, участвует в регуляции пролиферативных процессов, функции матриксообразующих клеток мезенхимальной линии [1-3].
Анализ причин нарушения биодоступности аргинина является одним из необходимых условий понимания патогенетических механизмов развития и разработки методов профилактики и лечения серьезных заболеваний человека, прежде всего атеросклероза, который является одним из основных факторов, ограничивающих продолжительность жизни.
Источники аргинина
L-аргинин является алифатической основной α-аминокислотой, содержащей два основных центра: в α-положении — аминогруппу, в δ-положении — гуанидиновую группу. Существует в виде L- и D-изомеров, но в белках млекопитающих присутствует только L-аргинин. Больше всего (до 85%) его содержится в основных белках — протаминах и гистонах. L-аргинином богаты мясо и орехи. L-аргинин — незаменимая у новорожденных и заменимая у здоровых взрослых аминокислота, вовлеченная в многочисленные физиологические процессы [1-3].
Источниками поступления аргинина являются: 1) синтез в системе тонкая кишка — почки из тонкокишечного глютамина и глутамата, глютамина плазмы крови, пролина пищи, NH3 и CO2, образованных кишечной микрофлорой; 2) деградация белков организма; 3) поступление и всасывание в кишечнике аргинина пищи; 4) локальные механизмы ферментативной рециркуляции цитруллина.
У млекопитающих существует метаболический путь для синтеза аргинина. Некоторые из ферментов на этом пути присутствуют во многих типах клеток, тогда как экспрессия других ферментов существенно ограничена. Фосфат-зависимая глутаминаза, орнитинаминотрансфераза (OAT), аргининсукцинатсинтаза (АСС), аргининсукцинатлиаза (АСЛ) и аспартатаминотрансфераза распространены в тканях животных, тогда как содержание карбомоилфосфата I, орнитилкарбомоилтрансферазы (OCT) и N-ацетилглутаматсинтазы в печени и слизистой оболочке кишки ограничено.
Оксидаза пролина присутствует главным образом в тонкой кишке, печени, почках, мозге, но синтетаза P5C локализована почти исключительно в слизистой кишечника, в других тканях она содержится только в небольшом количестве. Различия в экспрессии ферментов привели к четкому разделению метаболических функций различных органов [1].
Тонкокишечные глютамин и глутамат, глютамин плазмы крови, пролин пищи экстенсивно катаболизируются энтероцитами тонкой кишки и являются предшественниками синтеза цитруллина. У взрослых цитруллин также синтезируется тонкой кишкой с NH3 и CO2 при участии ферментов орнитинкарбамоилфосфатсинтетазы I, орнитинтранскарбамоилазы и поставляется в почки и другие ткани для синтеза аргинина. Цитруллин, поступающий из крови, под действием AСС и AСЛ преобразуется в почках в аргинин. Почка также экспрессирует аргиназы (катализирует гидролиз L-аргинина с образованием орнитина и мочевины), но аргиназы и ферменты биосинтеза аргинина локализованы отдельно, в рамках различных частей нефрона, так, чтобы коэкспресия этих антагонистических ферментативных метаболических путей в пределах одной клетки отсутствовала или была ограничена.
Синтез аргинина de novo у взрослых составляет лишь 5–15% эндогенного пула, главная составляющая которого — деградация белков тела. У здоровых взрослых эндогенный синтез аргинина не играет главную роль в регулировании его гомеостаза. Кроме того, эндогенное образование (de novo и вследствие деградации белков организма) аргинина обеспечивает его достаточное количество без потребности в поступлении извне. Но при определенных условиях, включая воспаление, дисфункции тонкой кишки или почек, эндогенный синтез не может обеспечить достаточное количество аргинина, соответствующее метаболическим требованиям [1-3].
Для взрослого человека ежедневное употребление L-аргинина с пищей в среднем составляет 5,4 г [4]. Из-за высокой активности аргиназ до 40% аргинина, поступающего с пищей, разрушается в процессе абсорбции, а большая его часть поступает в воротную вену. В зависимости от возраста и рациона, концентрация L-аргинина в плазме крови человека и животных колеблется в пределах от 95 мкмоль/л до 250 мкмоль/л.
Катаболизм аргинина
Аргинин как субстрат используется несколькими метаболическими путями, большинство из которых функционируют в рамках одной и той же клетки. В зависимости от конкретного органа или типа клеток, аргинин является предшественником различных молекул, включая NO, креатин, мочевину, полиамины, L-пролин, L-орнитин, глутамат и агматин [1].
Доступность аргинина различным метаболическим путям зависит от его способности проходить сквозь плазматические и митохондриальные мембраны. Транспорт аргинина сквозь клеточную мембрану осуществляется с участием катионных аминокислотных транспортеров САТ-1/2/3. Основным является САТ-1, активность которого возрастает с повышением уровня внеклеточного аргинина или под воздействием специфических стимулов. Изменения функции CAT способны в разной степени ограничивать в клетках доступность аргинина для индуцибельной синтазы оксида азота (iNOS) [1].
L-аргинин выступает субстратом для синтаз оксида азота (NOS), продуцирующих оксид азота (NO). NO, образующийся в эндотелии сосудов эндотелиальной NOS (еNOS), отвечает за релаксацию гладких мышц и необходим для снижения артериального давления. L-аргинин также используется клетками иммунной системы, где NOS продуцирует NO для клеточного сигналинга или окислительных бактерицидных действий [5].
Эндотелиальный оксид азота / NO-синтетазы (NO/NOS)
Оксид азота (NO) выполняет ключевые регуляторные функции, включая вазодилатацию и поглощение глюкозы. Снижение продукции NO может привести к клеточной дисфункции, торможению кровообращения, нарушению секреции инсулина и транспорта глюкозы, усилению резистентности к инсулину и гипертонии, а также к диабету. Образование NO подавляется на фоне сердечно-сосудистых и метаболических заболеваний, вызывая серьезные нарушения [6]. К числу механизмов, составляющих основу более низкой продукции/доступности NO при метаболических и сердечно-сосудистых заболеваниях, можно отнести снижение уровня инсулина в крови, увеличение выработки ангиотензина II, гипергомоцистеинемию, усиление синтеза асимметричного диметиларгинина (AДMA) и низкую концентрацию L-аргинина в плазме [7].
Эндотелиальный оксид азота — важный вазореактивный фактор [5]. В свободном состоянии период его полувыведения составляет от 6 с до 30 с, после чего он быстро разрушается. NO синтезируется из L-аргинина тремя изоформами NOS. Они присоединяют молекулярный кислород к атому азота из терминальной гуанидиновой группы L-аргинина с образованием NO и L-цитруллина [2, 8]. Три димерные изоформы NOS кодируются разными генами: нейрональной nNOS (тип 1 NOS, ген NOS1), индуцибельной iNOS (тип 2 NOS, NOS2) и эндотелиальной eNOS (тип 3 NOS, NOS3).
Изоформы nNOS и eNOS являются конститутивными. eNOS и ферменты рециркуляции аргинина АСС и AСЛ, катионные аминокислотные транспортеры CAT локализованы в кавеолярных углублениях на липидных рафтах плазматической мембраны эндотелиоцитов, где они формируют функционально и пространственно ассоциированный ферментный комплекс [1-3].
nNOS и eNOS регулируются транскрипционными, посттранскрипционными (микроРНК) и посттрансляционными механизмами, включая фосфорилирование, ацетилирование, S-нитрозилирование, S-глутатионилирование и межбелковые взаимодействия. iNOS в основном регулируется с помощью транскрипции генов в условиях провоспалительного и окислительного стресса.
NOS представляет собой оксидоредуктазы, гомодимеры, состоящие из аминоконечного оксигеназного домена, который содержит сайты связывания субстрата — L-аргинина, кофактора тетрагидробиоптерина (BH4), кластера гема, содержащего железо, а также домена редуктазы с сайтами связывания для доноров электронов: никотинамид-аденин-динуклеотидфосфата (NADPH), флавин-аденин-динуклеотида (FAD) и флавин-мононуклеотида (FMN). Оба домена соединены последовательностью, связывающей комплекс кальмодулин-Ca2+.
При активации NOS флавины в редуктазном домене переносят полученные от NADPH электроны на гем в оксигеназном домене другого мономера, обеспечивая связывание кислорода (O2) с восстановленным железом гема (Fe2+) и преобразование L-аргинина в HO-L-аргинин, а затем в NO и L-цитруллин [9]. Кофакторами активации eNOS выступают протопорфирин-IX, BH4, FMN, FAD и ионы Zn2+, которые тетраидально связывают мономеры через цистеиновые остатки. eNOS — основная изоформа NOS в нормальной стенке [10]. Рекрутирование комплекса Ca2+-кальмодулин необходимо для переноса электронов.
Значительное увеличение внутриклеточной концентрации Ca2+ необходимо, чтобы этот комплекс связывал eNOS и nNOS, тогда как связывание iNOS происходит при базальных концентрациях Ca2+. BH4, связанный с димерами NOS, необходим для их стабилизации и надлежащей каталитической активности. В противном случае электроны переносятся непосредственно на O2, и вместо NO вырабатываются супероксидные анионы (O2–). Субклеточная локализация NOS определяет синтез NO в компартментах и передачу сигналов по регуляторной цепи специфическим эффекторам [9].
eNOS — важнейшая синтаза — синтезируется как гомодимер, который транспортируется к клеточной мембране в места образования ею особых инвагинаций кавеол, где депонируется в функционально неактивном состоянии, связываясь с кавеолином-1 — главным белком, ответственным за формирование и поддержание формы кавеол [10]. Синтез NO требует точного соотношения субстрата и кофакторов. Напряжение смещения, вызванное вязкой природой кровообращения, проходящего вдоль сосудистой стенки, активирует eNOS путем фосфорилирования различными протеинкиназами. Akt фосфорилирует eNOS по Ser1177, ее основному сайту активации, а ингибирующий остаток Thr495 дефосфорилируется фосфатазами PP1, PP2A и кальциневрином (PP2B) [9].
Активированный фермент затем транслоцируется в цитозоль. Фосфорилировать eNOS по Ser1177 могут другие киназы, включая AMPK, кальций/кальмодулин-зависимую протеинкиназу II типа и протеинкиназу A. Фосфорилирование Ser615 или Ser633 (киназами Akt, AMPK, PKA или Pim-1) [11] и Tyr81 тирозинкиназой Src также связано с увеличением продукции NO. И наоборот, фосфорилирование по Ser114 киназами ERK1/2, протеинкиназой C и Tyr657 тирозинкиназой 2β (PYK2) снижает синтез NO [9, 12].
NO диффундирует в клетки гладкой мускулатуры сосудов, активирует гуанилатциклазу и индуцирует опосредованную сGMP (циклический гуанозин 3′,5′-монофосфат) релаксацию гладких мышц путем активации cGMP-зависимой протеинкиназы G (PKG) и дальнейшего фосфорилирования белков калиевых каналов, снижения уровня кальция в цитозоле и дефосфорилирования легкой цепи миозина [4, 8]. В конечном итоге это регулирует региональное кровообращение (то есть поток-опосредованную дилатацию). Другие субстраты и кофакторы, необходимые для этой реакции, включают кислород, NADPH, флавин, гем и BH4 [4]. Последний связывается с гем-группой N-концевого оксидазного домена NOS, стабилизируя димерную молекулу. Связывание переводит NOS в высокое спиновое состояние, увеличивает активность фермента и усиливает родство NOS с аргинином [13].
В нормальных условиях eNOS в присутствии достаточного количества BH4 принимает и сохраняет электроны из NADPH для преобразования косубстратов O2 и L-аргинина в NO и L-цитруллин [14]. BH4 принимает электроны от флавина в С-конечном редуктазном участке NOS во время синтеза NO и L-цитруллина, действуя как важный окислительно-восстановительный агент. Дисфункция на любой из этих стадий, например в процессе старения, может привести к нарушению реакции, снижению биодоступности NO, ослаблению вазодилатации и изменениям в региональной циркуляции и перфузии тканей [13].
NO, синтезированный eNOS, выполняет целый ряд функций:
- Является одним из самых мощных вазодилататоров, релаксирующим фактором для гастроинтестинального тракта, дыхательных путей — проникая из эндотелиальных клеток в клетки гладких мышц сосудистой стенки, он активирует растворимую гуанилатциклазу, взаимодействуя с атомом железа в активном центре фермента, что ведет к повышению уровня сGMP, активации PKG, снижению концентрации кальция, расслаблению сосудов [10, 15];
- Опосредует сосудорасширяющие эффекты эндотелий-зависимых вазодилататоров (ацетилхолина, брадикинина, гистамина и т. д.), тормозит образование эндотелиального сосудосуживающего фактора — эндотелина-1 — и высвобождение норадреналина окончаниями симпатических нейронов, препятствует осуществлению чрезмерных эффектов других вазоконстрикторов (ангиотензина, тромбоксана A2); благодаря этому NO активно участвует в регуляции сосудистого тонуса и кровообращения (в том числе базального), артериального давления, системной и региональной гемодинамики [15];
- Стимулирует синтез эндотелиального фактора роста и ангиогенез, но тормозит пролиферацию и миграцию гладкомышечных клеток (тем самым препятствуя образованию неоинтимы) и гипертрофию сосудов [4, 8];
- В небольших концентрациях тормозит, а в высоких — усиливает апоптоз, подавляет синтез внеклеточного матрикса, чем поддерживает нормальную структуру сосудистой стенки [4, 8];
- Оказывает мощное противовоспалительное и антитромбогенное действие: тормозит транскрипцию провоспалительного ядерного фактора каппа B (NF-κB), блокирует стимулированную цитокинами экспрессию адгезионных молекул эндотелия (VCAM-I, E-селектин, MCP) и хемотаксических пептидов моноцитов, уменьшает прилипание, инфильтрацию, агрегацию нейтрофилов и моноцитов, преобразование последних в макрофаги, тормозит агрегацию и адгезию тромбоцитов, экспрессию фактора, активирующего тромбоциты;
- Обладает антиоксидантными свойствами, препятствует патогенным воздействиям липопротеинов низкой плотности [4, 11]; 7) NO/NOS участвуют в опосредованной РКС регуляции альдостерона ионами калия, что связано с поддержанием водно-солевого баланса и тонуса сосудов в организме [16].
Роль аргинина в патологических процессах
Основным следствием недостатка аргинина в организме является снижение продукции NO. NO, продуцируемый в эндотелии сосудов еNOS, отвечает за релаксацию гладких мышц и необходим для снижения артериального давления. Любое улучшение функции эндотелия способствует профилактике сердечно-сосудистых заболеваний (ССЗ). Показано, что введение L-аргинина значительно уменьшает систолическое и диастолическое артериальное давление, но у беременных женщин снижалось только диастолическое артериальное давление. Добавка L-аргинина также значительно улучшала функцию эндотелия сосудов. Важно влияние аргинина на иммунную систему. Пациенты, получавшие внутривенную терапию L-аргинином, демонстрировали значительное увеличение количества CD4+ лимфоцитов (Т-хелперов) [2, 3].
L-аргинин и сердечно-сосудистая система. В физиологии и патофизиологии CCC эффект NO является ключевым в эндотелий-зависимой дилатации сосудов [2, 3] — рис. Показано, что ингибирование NOS и, следовательно, снижение продукции NO вызывает гипертонию и гипертрофию сердца, приводит к развитию атеросклероза. L-аргинин является единственным предшественником синтеза NO, а его катаболические ферменты, оказывающие наибольшее влияние на CСС, — это NOS и аргиназа [2, 3, 17]. L-аргинин является субстратом для NOS, которая превращает его в L-цитруллин с высвобождением NO. Из цитруллина L-аргинин может быть восстановлен ферментами АСС и AСЛ [2, 3], но может разрушаться аргиназами. Снижение биодоступности NO вследствие уменьшения продукции NOS или образования активных форм кислорода (ROS) связано с развитием различных сосудистых нарушений [18], включая вазоконстрикцию, агрегацию тромбоцитов и образование тромба, адгезию лейкоцитов, пролиферацию и миграцию гладкомышечных клеток сосудов (VSMC) [19].
Кроме того, эндотелиальная дисфункция (ЭД), возникающая на ранних стадиях развития атеросклероза, также связана с нарушением биодоступности NO [19, 20]. Биологическую активность NO подавляют многочисленные факторы, такие как снижение поглощения L-аргинина, уменьшение содержания кофакторов NOS (Ca2+, кальмодулин, BH4), подавление потока электронов (NADPH, флавин), подавление экспрессии NOS [18, 19].
Кратковременное и хроническое введение L-аргинина улучшало функцию эндотелия на животных моделях гиперхолестеринемии и атеросклероза [21]. Повышение его концентрации в плазме приводит к увеличению продукции как сосудистого, так и системного NO. Исследования VSMC показали, что ограничивающим фактором для усиления синтеза NO с помощью iNOS является возможность рециклинга L-аргинина [2, 3].
Показано, что активность iNOS зависит от концентрации внеклеточного L-аргинина. Возможность существования внутриклеточного пула L-аргинина, недоступного для iNOS, вследствие чего внеклеточный аргинин необходим для активности iNOS и продукции NO, получила название «парадокс L-аргинина» и относится к конкретной ситуации, когда добавка L-аргинина стимулирует активность NOS и выработки NO, даже если уровень L-аргинина в плазме находится в физиологических пределах [18].
Эндокринные механизмы также могут способствовать вазодилатации, вызванной L-аргинином. Высокие внутривенные дозы L-аргинина стимулируют секрецию гормона роста (GH). GH и инсулин, высвобождение которого также стимулируется L-аргинином, могут вызвать вазодилатацию [18].
Внутривенная инфузия L-аргинина или D-аргинина вызвала вазодилатацию. Это позволяет предположить, что такой эффект связан с осмоляльностью или pH, а не только с усилением образования эндотелиального NO. Вазодилатация была значительной только при высоких концентрациях L-аргинина в плазме — от микро- до миллимолярных [22].
Системное или пероральное введение L-аргинина улучшает сердечно-сосудистую функцию и уменьшает ишемию сердца у пациентов, имеющих заболевания коронарных артерий, а также приводит к снижению артериального давления и сосудистого сопротивления в почках у пациентов с гипертонической болезнью и нормальной или нарушенной функцией почек. Хотя концентрация L-аргинина в плазме у пациентов с гиперхолестеринемией остается неизменной, пероральное или внутривенное введение L-аргинина может восстановить эндотелиальную функцию у них.
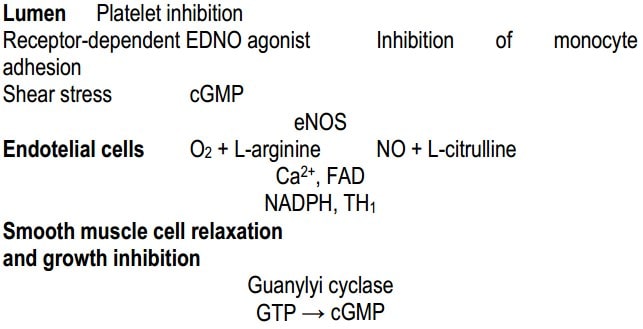
/рис./
Рис. Схема действия аргинина и NO в стенке кровеносного сосуда (beloveshkin.com): в эндотелии eNOS окисляет аргинин до NO и цитруллина; NO противодействует воспалительному процессу (в данном случае вызванному напряжением смещения), подавляя адгезию моноцитов, формирование тромба и релаксируя слой гладкомышечной мускулатуры, расположенный ниже.
Существует мнение, что атеросклероз вызван нехваткой L-аргинина, скорее всего, из-за нарушенных взаимосвязи между лизином и L-аргинином и взаимодействия между метаболизмом эстрогена и L-аргинина [18]. L-аргинин участвует в профилактике атеросклероза и эффективно снижает негативное влияние уже присутствующих атеросклеротических изменений. Так, он замедляет адгезию моноцитов к эндотелию, снижает артериальное давление у некоторых пациентов с гипертонией и возвращает эндотелиальную функцию в норму у пациентов с гиперхолестеринемией.
Таким образом, L-аргинин имеет высокий функциональный приоритет в продукции NO, а следовательно, в физиологии ССС. Регуляция биодоступности NO после применения препаратов L-аргинина имеет решающее значение для разработки новых стратегий лечения ССЗ. L-аргинин является одним из возможных терапевтических средств для коррекции различных сердечно-сосудистых нарушений.
L-аргинин и цереброваскулярная система. Фенотипы эндотелиальных клеток по-разному регулируются в пространстве и времени, определяя феномен гетерогенности эндотелия. Церебральный эндотелий, вероятно, является одним из самых специфических типов, поскольку он выступает важнейшим элементом гематоэнцефалического барьера. ЭД головного мозга участвует в патофизиологии ряда неврологических заболеваний [23].
В дополнение к атеросклерозу дисфункция эндотелия системы мозгового кровообращения может быть вовлечена в патогенез церебральных заболеваний мелких сосудов и болезни Альцгеймера. Нарушение NO-зависимой вазодилатации может также увеличить участок повреждения во время инсульта из-за нарушения коллатерального кровообращения [24]. Церебральная авторегуляция поддерживает постоянное кровообращение (CBF) через мозг, несмотря на изменения среднего артериального давления, и зависит, по крайней мере частично, от изменений локальной концентрации L-аргинина в мозге и скорости его метаболизма [25].
Авторегуляция мозгового кровообращения состоит из механо- и хеморегуляции. Хеморегуляция прямо коррелирует с сывороточным уровнем CO2 и, в отличие от механорегуляции, не зависит от изменений среднего артериального давления. Механорегуляция зависит от трансмурального градиента давления и эндотелиальной вазодилатации. Механорегуляция является основным контролирующим механизмом CBF. Известно, что эндотелиальная вазодилатация крупных артерий наиболее выражена в сосудистой сети головного мозга [23]. Нормальная функция эндотелия имеет решающее значение для регуляции CBF. Дисфункциональный церебральный эндотелий выделяет меньше NO, в результате чего нарушается расслабление клеток гладких мышц мелких артерий.
Самой важной ролью L-аргинина является его влияние на эндотелиальные клетки сосудов мозга, а следовательно, на кровообращение. Внутривенное введение L-аргинина вызывает расширение сосудов и увеличение кровообращения в системе микроциркуляции. К тому же показано, что L-аргинин играет роль в снижении тромботической активности, пролиферации клеток, воспаления и других процессов, которые приводят к нарушениям сосудистой системы мозга.
Доказано, что использование L-аргинина является безопасным. NO известен как самый эффективный вазодилататор и основной предиктор сосудистого тонуса в цереброваскулярной системе [26]. Из трех изоформ NOS именно eNOS является основой NO-опосредованной вазодилатации мозговых артерий и артериол [23]. Показано, что еNOS-зависимое продуцирование NO в эндотелии мозга снижает активность симпатической нервной системы и артериальное давление у крыс. Аналогично сверхэкспрессия eNOS в ростральной вентролатеральной части продолговатого мозга и ядрах солитарного тракта уменьшает артериальное давление и активность симпатического нерва.
Новые данные, полученные в результате прямого измерения симпатической нервной активности с использованием имплантированных электродов, указывают, что экзогенный NO может уменьшить влияние симпатической нервной системы на сердце [27, 28]. Есть также данные, что снижение биодоступности NO в паравентрикулярном ядре усиливает разрядку почечного симпатического нерва. Снижение уровней NO может увеличить симпатическое влияние на почку в связи с усилением специфического подавления eNOS-зависимого продуцирования NO в паравентрикулярном ядре гипоталамуса, что повышает реакцию почечного симпатического нерва (RSNA). Подавление NOS путем введения NG-метил-1-аргинина также увеличивает RSNA [29].
Церебральная эндотелиальная функция может быть разной на разных цереброваскулярных участках. Кроме того, некоторые участки мозга могут быть более склонными к ишемии и инсульту. Отмечены большая частота и распространенность инсульта среди мужчин. Определение цереброваскулярной реактивности на L-аргинин (CVR-L-Arg) является уникальным, недорогим, многообещающим неинвазивным методом обследования, который может предоставить средства для оценки функции эндотелия головного мозга в физиологических и патологических состояниях.
Сравнение CVR-L-Arg в кровообращении передней и задней частей мозга у здоровых молодых мужчин и женщин показало, что CVR-L-Arg была значительно выше в задней мозговой артерии (PCA), чем в средней мозговой артерии (MCA). Кроме того, CVR-LArg была более выраженной у женщин, чем у мужчин, в PCA и MCA. Низкая CVR-L-Arg (а следовательно, и низкая эндотелиальная функция головного мозга) в кровообращении передней части мозга у мужчин могут объяснять большую частоту ишемии и инсультов у них [23].
Цереброваскулярная дисфункция, вызванная экзогенными стрессовыми факторами, включает внутричерепную гипертензию, гипоперфузию и воспаление головного мозга. Лечение L-аргинином сразу после стресса значительно улучшало выживание животных, уменьшало внутричерепную гипертензию и увеличивало содержание метаболитов NO, глутамата, глицерина, лактат-пирувата и дигидроксибензойной кислоты в гипоталамусе.
Обусловленные экзогенными факторами повышенные уровни провоспалительных IL-1β и TNF-α в гипоталамусе также снижались на фоне лечения L-аргинином. Наоборот, уровни противовоспалительного IL-10 в гипоталамусе значительно повышались. Результаты показывают, что L-аргинин может ослаблять негативное влияние экзогенных стрессовых факторов за счет снижения цереброваскулярной дисфункции и воспаления мозга [30].
L-аргинин и диабет. Диабет 2-го типа (СД2) стал глобальной проблемой здравоохранения, затрагивающей около 425 миллионов человек во всем мире. Это в перспективе может вызвать множество осложнений и привести к большей смертности. В настоящее время нет доступных лекарств для эффективной профилактики диабета. L-аргинин как предшественник NO играет важную роль в гомеостазе, иммунитете, размножении, росте, задержке старения человека и животных.
Все больше клинических данных свидетельствуют, что пищевые добавки с L-аргинином могут уменьшать ожирение, снижать артериальное давление, окислительные процессы, ЭД, замедляя прогрессирование предиабета в клинически выраженный СД2. Потенциальным молекулярным механизмом может быть моделирование гомеостаза глюкозы, стимулирование липолиза, поддержание уровней гормонов, ослабление инсулинорезистентности на этапе предиабета. Возможный сигналинг действия L-аргинина, вероятно, включает в себя путь L-аргинин/NO, через который могут быть активированы другие клеточные сигнальные каскады [31]. Собранные данные показали, что L-аргинин может потенциально предотвращать развитие и облегчать течение СД2 путем восстановления чувствительности к инсулину.
Следует отметить, что при СД2 содержание антагониста L-аргинина — ADMA (ассиметричный диметиларгинин — эндогенный фактор, подавляющий синтез NO) — увеличивалось в плазме в 2,5 раза, что было связано со снижением NO-зависимой функции — вазодилатации плечевой артерии после индуцированной ишемией гиперемии [32]. Количество ADMA в плазме увеличивалось и в ответ на прием пищи с высоким содержанием жира, что также было связано с уменьшением степени вазодилатации. Эти изменения ассоциировались с повышением уровня триглицеридов в плазме крови и триглицеридов, входящих в состав липопротеинов очень низкой плотности. Увеличение содержания ADMA при диабете сопровождалось нарушением эндотелий-зависимой релаксации и плохим метаболическим контролем.
Повышенная концентрация ADMA может вызвать связанную с диабетом ЭД и макроангиопатии. Важно отметить, что ингибиторы ангиотензинпреобразующего фермента, но не глитазоны, снижали уровни ADMA в плазме с СД2, несмотря на то что глитазоны улучшали функцию эндотелия и уменьшали экспрессию маркеров воспаления [33].
Эндотелиальные клетки вырабатывают NO — вазодилататор и антиагрегатный фактор тромбоцитов, концентрация которого снижается у пациентов с гипертонией и СД2. Диеты, обогащенные углеводами и насыщенными жирами, уменьшают образование NO, вызывают ЭД и повышают сопротивление периферических сосудов. Уровни ADMA в крови повышены у пациентов с ожирением, дислипидемией, гипертонией, СД2, гестационным СД и преэклампсией.
Повышение количества ADMA в крови, видимо, предшествует развитию гипертонии и СД2. Уровни ADMA в крови коррелировали с неконтролируемой гипергликемией, диабетическими микро- и макроангиопатиями. Добавка L-аргинина снижает ЭД и восстанавливает нормальное сопротивление периферических сосудов за счет снижения уровня ADMA в крови и усиления продукции NO [33].
L-аргинин стимулирует секрецию различных гормонов, включая GH, инсулин, глюкагон, адреналин, норадреналин и пролактин [34]. Инсулин, в свою очередь, стимулирует экспрессию САТ-1 и транспорт L-аргинина в эндотелиальные клетки. Поэтому у больных диабетом снижается содержание L-аргинина и NO в клетках сосудов [35]. Длительное пероральное введение L-аргинина повышает чувствительность к инсулину и метаболизм глюкозы с одновременным улучшением функции эндотелия у пациентов с СД2 [36]. L-аргинин (6,4 г/сут) значительно увеличивает регрессию к нормальной толерантности к глюкозе, повышая чувствительность к инсулину у пациентов, а также в некоторых моделях диабета и у крыс с ожирением [37].
Способность L-аргинина ослаблять эффекты метилглиоксаля, реактивного метаболита глюкозы и предшественника конечных продуктов гликирования (AGE), может составлять основу положительных эффектов приема L-аргинина у людей с диабетом [38]. Как D-аргинин, так и L-аргинин могут ослаблять экспрессию аргиназы I и II, окислительный стресс, ЭД и образование AGE, вызванное метилглиоксалем и высоким содержанием глюкозы. L-аргинин может предотвращать индуцированную метилглиоксалем дисфункцию β-клеток поджелудочной железы, а также снижать поглощение глюкозы жировой тканью [38], что потенциально объясняет повышение чувствительности к инсулину [36, 38].
Показано, что пероральный прием L-аргинина может усиливать транскрипцию гуанозинтрифосфатциклогидролазы I, первого фермента в синтезе BH4 de novo, увеличивая образование BH4 и NO, а также снижая уровень глюкозы в плазме при диабете 1-го типа у крыс. BH4, один из самых сильных антиоксидантов в клетке, играет решающую роль не только в увеличении скорости синтеза NO с помощью eNOS, но и в уменьшении образования O2 — в эндотелиальных клетках. Повышение уровня как субстрата eNOS, L-аргинина, так и ее критического кофактора, BH4, необходимо для обеспечения адекватного синтеза NO в эндотелии [36].
L-аргинин и ожирение. Ожирение связано со снижением транспорта L-аргинина даже при отсутствии метаболического синдрома [39]. Распространенным следствием ожирения является гипертензия, которая наблюдается при ожирении примерно в 75% и 65% случаев у мужчин и женщин соответственно. Часто субъекты с ожирением устойчивы к стандартным антигипертензивным препаратам, а плохое понимание точных механизмов, составляющих основу связи между ожирением и гипертонией, препятствует развитию новой и эффективной терапии. Установлено, что ожирение связано с уменьшением биодоступности NO, вызванной нарушением транспорта L-аргинина, и что усиление переноса эндотелиального аргинина предотвращает экспериментальную гипертензию, вызванную ожирением [40].
Результаты других исследований также предоставляют четкие доказательства, что ЭД играет важную роль в патогенезе гипертонии, связанной с ожирением [40]. Добавка L-аргинина значительно улучшала эндотелиальную функцию сосудов. Для пациентов с гипертонической болезнью применение L-аргинина заметно снижало как систолическое, так и диастолическое артериальное давление. Эти данные были получены более чем у 600 000 участников, поэтому можно утверждать, что умеренные изменения в артериальном давлении являются клинически значимыми, поскольку снижение систолического артериального давления на 5 мм рт. ст. связано со снижением риска инсульта на 14% и на 9% — риска ишемической болезни сердца [5, 41].
Хорошо известно, что NO снижает окислительный стресс, и показано, что снижение уровня NO вместе с усилением окислительного стресса может провоцировать развитие гипертонической болезни, ассоциированной с ожирением [42]. Усиление специфического для эндотелия транспорта аргинина может предотвратить окислительный стресс в дополнение к увеличению биодоступности NO [28].
Хроническая активация ренин-ангиотензин-альдостероновой системы (РААС) является отличительной чертой гипертонии, связанной с ожирением [43]. В развитии гипертонии задействован как почечный, так и нейрогенный механизм [23]. В частности, усиленный симпатический отток, хроническая активация РААС, окислительный стресс и снижение доступности NO, особенно в почках, могут быть звеньями патогенеза гипертонической болезни, связанной с ожирением. Нарушение транспорта L-аргинина при ожирении может снизить биодоступность NO и тем самым усилить окислительный стресс и симпатический отток, вызвать активацию РААС и усилить следующие прогипертензивные эффекты симпатической нервной системы и РААС — порочный круг, ведущий к гипертонии.
При ожирении L-аргинин/NO могут смягчить эффекты РААС посредством 2 механизмов: во-первых, NO может снизить активацию РААС, и, во-вторых, NO может буферизовать индуцированную ангиотензином II периферическую вазоконстрикцию. Соответственно, стратегии лечения, которые увеличивают содержание L-аргинина и образование NO, вероятно, будут полезными при гипертонии, связанной с ожирением [28].
Все больше данных свидетельствуют, что прием аргинина эффективно уменьшает количество белой жировой ткани у крыс с ожирением и у пациентов с ожирением и СД2. Таким образом, аргинин можно использовать для профилактики и лечения ожирения и связанного с ним метаболического синдрома.
L-аргинин и диабетическая нейропатия. Диабетическая нейропатия (ДН) — характерное, распространенное, необратимое на поздних стадиях осложнение СД1 и СД2 [44]. ДН имеют 30% госпитализированных и 20% негоспитализированных лиц с диабетом. Она может проявляться даже у лиц с аномальной толерантностью к глюкозе, что является преддиабетическим состоянием [45]. ДН — самая распространенная форма нейропатии в развитых странах и основная причина нетравматических ампутаций [46].
В патогенезе ДН задействовано несколько сигнальных каскадов, в которых принимают участие циклооксигеназа-2 и оксид азота [46].
Патофизиология ДН включает: усиление окислительного стресса, который влечет за собой образование конечных продуктов гликирования (AGE), накопление полиолов, торможение эффектов NO и нарушение функции эндотелия, подавление активности Na+/K+-АТФазы и гомоцистеинемию. В гипергликемической среде не только быстрее разрушаются нервные клетки, но и нарушаются механизмы их восстановления. При экспериментальном диабете также отмечается пониженный уровень нейротропных агентов, включая нервный и инсулиноподобный факторы роста [45].
Сосудистые факторы также участвуют в патогенезе ДН. Нервное кровообращение уменьшается при экспериментальной диабетической нейропатии, и многочисленные исследования показывают, что это может быть обусловлено изменениями в метаболизме NO. Изучение нервного кровообращения и активности NOS в микрососудистой среде, «обслуживающей» периферические нервы у диабетических крыс, показало, что гипергликемия и N-нитро-L-аргинин, ингибитор NOS, провоцировали значительное ослабление нервного кровообращения по сравнению с контролем. L-аргинин снимал торможение NOS и восстанавливал приток крови к нервам [45].
Исследование на животных также выявило нарушения функционирования нейрональной синтазы оксида азота (nNOS) при экспериментальном диабете. Снижение экспрессии nNOS было связано с усилением невропатической боли. NO играет важную роль в контроле Na+/K+-АТФазной активности, снижение которой связано с патогенезом ДН. Показано, что в результате гипергликемии образуется избыток радикалов супероксида в эндотелии, что приводит к снижению стимуляции NO Na+/K+-АТФазной активности. Этот эффект тормозится L-аргинином [45].
Результаты исследований указывают на профилактический эффект L-аргинина, который наблюдался у диабетических крыс как на уровне поведения, так и на уровне гистологии. На молекулярном уровне аргинин подавлял спинномозговую миРНК-155 и ее мишень, расположенную ниже в регуляторной цепи — NO [46].
Показано, что L-аргинин предотвращает механическую гипералгезию, тактильную и термическую алодинию у крыс с индуцированным стрептозотоцином диабетом и нейропатией путем нормализации концентрации NO и повышения концентрации агматина в плазме крови. Пероральное введение L-аргинина также уменьшало полидипсию, полиурию, выделение азота с мочой и незначительно ограничивало гипоинсулинемию [44].
Таким образом, при СД прием аргинина может быть оригинальной терапевтической альтернативой без серьезных побочных эффектов для предотвращения возникновения нейропатической боли. Полученные данные подчеркивают терапевтические мишени и определяют профилактический подход к лечению ДН.
L-аргинин и старение. У пожилых людей периферическое сопротивление сосудов возрастает и артерии теряют способность к эффективной дилатации в связи с ЭД. Эта сосудистая сенесценция приводит к увеличению риска ССЗ в процессе старения [4]. В последнее время значительное внимание уделяется способности L-аргинина влиять на функцию эндотелия сосудов. С возрастом возникает распространенная дисфункция сосудов, которая проявляется в ослаблении дилятаторной способности периферических сосудов, обусловленном ЭД.
Эндотелий сосудов представляет собой одноклеточный слой, ответственный за многочисленные аутокринные, паракринные и эндокринные функции, включая регуляцию сосудистого тонуса, воспаление сосудов, клеточный рост, тромбоз и функции тромбоцитов. NO, мощный вазоактивный фактор, высвобождается эндотелиальными клетками в ответ на напряжение смещения, играет ключевую роль в поддержании сосудистой стенки в спокойном состоянии с помощью подавления воспаления, клеточной пролиферации и тромбоза [47, 48]. ЭД, связанная со старением, может быть результатом снижения как образования NO, так и его биодоступности. Утрата NO способствует переходу сосудистой стенки от спокойного состояния к активированному.
Экспрессия клетками сосудов хемокинов, цитокинов и молекул адгезии увеличивается, что приводит к вовлечению лейкоцитов, агрегации тромбоцитов и инициированию атеросклеротического процесса. ЭД развивается на ранних стадиях атерогенного процесса и является основным фактором развития любых морфологических атеросклеротических изменений [4, 47].
Напряжение смещения активирует eNOS с помощью фосфорилирования. NO диффундирует в клетки гладкой мускулатуры сосудов и вызывает релаксацию гладких мышц [8], что регулирует регионарное кровообращение. В процессе старения может снижаться доступность NO, ослабляться вазодилатация и меняться регионарная циркуляция и перфузия тканей [4]. Уменьшение количества аргинина может ограничивать скорость образования NO, а затем — и эндотелий-зависимую вазодилатацию. В настоящее время изучается возможность использования L-аргинина в качестве профилактического средства для защиты сосудистой сети от разрушительных последствий старения и болезней [4].
В отобранных популяциях пациентов пожилого и старческого возраста с ЭД и уменьшенными запасами L-аргинина показано, что добавление последнего в комплексную терапию может улучшать сосудистую функцию за счет увеличения содержания NO. L-аргинин может также восстановить функцию эндотелия с помощью дополнительных эффектов относительно системной гормональной модуляции (GH) и противовоспалительных/антиоксидантных изменений в эндотелиальных клетках [4].
Влияние аргинина на агрегацию тромбоцитов. Выявлено выраженное подавление агрегации тромбоцитов, индуцированной аденозин-5’-дифосфатом (ADP), коллагеном или тромбином, как после приема, так и после iv-введения L-аргинина кроликам. На кроликах с гиперхолестеринемией также показано, что длительное введение этой аминокислоты значительно подавляет индуцированную ADP-агрегацию тромбоцитов. Подобные данные были получены также в отношении крыс с алоксановым диабетом и свиней. Таким образом, результаты исследований на животных моделях четко показывают тормозящую роль L-аргинина относительно активности тромбоцитов [49, 50].
Клинические исследования также свидетельствуют о влиянии L-аргинина на агрегацию тромбоцитов. После введения L-аргинина в течение 7 дней для лечения периферических артериальных обструктивных заболеваний наблюдали подавление спонтанной, коллаген- и ADP-индуцированной агрегации тромбоцитов. Терапия этой аминокислотой снижала способность тромбоцитов к агрегации у пациентов с гиперхолестеринемией, СД2 и артериальной гипертензией. Отмечена нормализация коллаген-индуцированной агрегации у пациентов с повышенным уровнем холестерина после перорального введения L-аргинина. Его положительный эффект наблюдался также при острой коронарной недостаточности. Препарат улучшал эндотелиальную функцию и подавлял ADP-индуцированную агрегацию тромбоцитов [49].
Таким образом, полученные результаты показывают, что L-аргинин может модифицировать гемостаз путем подавления коагуляции и активации фибринолиза.
Другие эффекты L-аргинина. L-аргинин регулирует множественные метаболические пути, связанные с метаболизмом жирных кислот, глюкозы, аминокислот и белков с помощью передачи сигналов в клетках и контроля экспрессии генов. Кроме того, аргинин регулирует перекрестные взаимодействия между адипоцитами и мышцами и распределение энергии посредством секреции цитокинов и гормонов. Аргинин усиливает экспрессию и активность AMP-активированной протеинкиназы (AMPK), тем самым модулируя энергетический баланс и липидный обмен в сторону уменьшения количества триацилглицеридов [51].
В настоящее время аргинин признан физиологически важным питательным веществом для поддержания репродуктивной функции у мужчин и женщин [51].
L-аргинин также используется клетками иммунной системы и может помочь снизить уровень инфицирования, особенно в ситуациях, связанных с нарушением иммунной функции, таких как хирургическое вмешательство или серьезное заболевание [52].
Для хирургических или госпитализированных пациентов показано, что L-аргинин значительно (на 40%) уменьшает возможность заражения больничной инфекцией и возникновения инфекционных осложнений, включая пневмонию, абсцесс брюшной полости, септический шок, фасции и инфекции мочеполового тракта. Иммунные клетки используют L-аргинин для продуцирования NO (через иNOS) для усиления клеточной иммунной функции путем модуляции образования цитокинов, а также пролиферации и дифференцирования лимфоцитов. У пациентов, принимавших препараты аргинина, количество CD4+ Т-клеток значительно увеличивалось [5].
В последнее время большое внимание уделяется влиянию нарушений метаболизма L-аргинина на канцерогенез и иммунную систему. L-aргинин необходим для созревания дзета-рецептора Т-клеток (TCRζ), а его отсутствие лишает Т-клетки способности взаимодействовать с опухолевыми антигенами. В миелоидных клетках-супрессорах содержание L-аргинина истощается из-за высокого уровня экспрессии аргиназы, а их количество увеличивается в 4–10 раз в зависимости от типа рака. Показано, что L-аргинин необходим для выживания и прогрессии аргинин-ауксотрофных опухолей.
Однако прогрессия неауксотрофных по аргинину опухолей не зависит от экзогенного L-аргинина, поскольку эти опухоли имеют активность АСС1 и способны продуцировать L-аргинин из цитруллина. Клинические исследования подтвердили высокую эффективность терапии ауксотрофных по аргинину опухолей, основанной на элиминации L-аргинина. Добавление L-аргинина может улучшить результаты лечения пациентов с неауксотрофным по аргинину раком [53].
L-аргинин влияет на синтез белка и ускоряет заживление ран, усиливая синтез пролина, что важно для образования коллагена, а также синтез полиаминов, которые способствуют росту клеток, пролиферации и дифференцированию [54]. Как отмечалось, L-аргинин стимулирует секрецию нескольких анаболических гормонов, таких как инсулин, гормон роста и инсулиноподобный фактор роста [55].
Известно, что концентрация L-аргинина значительно снижается у женщин с гестационной гипертензией или преэклампсией [56]. Также у них значительно снижены уровни циркулирующего NO. Отмечено, что у беременных с преэклампсией увеличиваются уровни супероксида, который быстро реагирует с NO, что приводит к значительному сокращению пула NO в циркуляции и дальнейшему повышению артериального давления. Поэтому увеличение продуцирования NO с использованием L-аргинина может преодолеть окислительные эффекты супероксида и значительно снизить артериальное давление [5].
Выводы
Структура молекулы L-аргинина предусматривает его участие в большом количестве клеточных процессов. Он находится в активных участках многих белков. Его структура благоприятна для связывания фосфатного аниона и поэтому катализирует реакции фосфорилирования. Аргинин играет важную роль в поддержании заряда многих белков. Он способствует детоксикации аммиака, секреции гормонов и участвует в поддержании иммунной системы.
Преобразование аргинина в NO способствует лечению различных патологий, таких как сердечно-сосудистые заболевания, заболевания периферических сосудов, эректильная дисфункция, атеросклероз, стенокардия, мигрень, путем усиления вазодилатации. Аргинин ускоряет синтез белков, контролирует истощение тканей у людей с миопатией, а также стимулирует продуцирование спермы. L-аргинин может оказывать комплексное воздействие на тромбоциты, коагуляцию и фибринолитические системы [57, 58].
Поэтому следует учитывать терапевтический потенциал L-аргинина и продолжать изучение возможностей его использования в качестве перспективного профилактического средства относительно прогрессирования сосудистой дисфункции, связанной со старением, диабетом и сердечно-сосудистыми заболеваниями. Особое внимание следует уделить способности L-аргинина модулировать системное воспаление, что, в свою очередь, может оказать положительное влияние на эндотелиальную функцию сосудов.
Авторы:
Л.К. Соколова, В.М. Пушкарев, Н.Д. Тронько
ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины»
Литература:
- Литвяков А.М., Сергиевич А.В. Аргинин-зависимые механизмы в патогенезе атеросклероза. Весцi НАН Беларусi. 2013;1:103-12. (Litvyakov AM, Sergiyevich AV. Arginine-dependent mechanisms in the pathogenesis of atherosclerosis. Vestsi NAN Belarusi. 2013;1:103-12).
- Morris SM Jr. Recent advances in arginine metabolism: roles and regulation of the arginases. Br J Pharmacol. 2009;157(6):922-30.
- Morris SM Jr. Arginine metabolism revisited. J Nutr. 2016;146(12):2579S-86S.
- Heffernan KS, Fahs CA, Ranadive SM, Patvardhan EA. L-arginine as a nutritional prophylaxis against vascular endothelial dysfunction with aging. J Cardiovasc Pharmacol Ther. 2010;15(1):17-23.
- McRae MP. Therapeutic benefits of l-Arginine: an umbrella review of meta-analyses. J Chiropr Med. 2016;15(3):184-9.
- Krause M, Rodrigues-Krause J, O’Hagan C, De Vito G, Boreham C, Susta D, et al. Differential nitric oxide levels in the blood and skeletal muscle of type 2 diabetic subjects may be consequence of adiposity: a preliminary study. Metabolism. 2012;61(11):1528-37.
- Rodrigues-Krause J, Krause M, Rocha IMGD, Umpierre D, Fayh APT. Association of l-Arginine supplementation with markers of endothelial function in patients with cardiovascular or metabolic disorders: a systematic review and meta-analysis. Nutrients. 2018;11(1):E15.
- Michael SK, Surks HK, Wang Y. High blood pressure arising from a defect in vascular function. Proc Natl Acad Sci U S A. 2008; 105(8):6702–7.
- Farah C, Michel LYM, Balligand JL. Nitric oxide signalling in cardiovascular health and disease. Nat Rev Cardiol. 2018;15(5):292-316.
- Марков Х.М. Молекулярные механизмы дисфункции сосудистого эндотелия. Кардиология. 2005;6:87-95. (Markov KhM. Molecular mechanisms of vascular endothelial dysfunction. Kardiologiya. 2005;6:87-95).
- Chen M, Yi B, Zhu N, Wei X, Zhang GX, Huang S, et al. Pim1 kinase promotes angiogenesis through phosphorylation of endothelial nitric oxide synthase at Ser633. Cardiovasc Res. 2016;109:141-50.
- Bibli SI, Zhou Z, Zukunft S, Fisslthaler B, Andreadou I, Szabo C, et al. Tyrosine phosphorylation of eNOS regulates myocardial survival after an ischaemic insult: role of PYK2. Cardiovasc Res. 2017;113:926-37.
- Heffernan KS, Vieira VJ, Valentine RJ. Microvascular function and ageing L-arginine, tetrahydrobiopterin and the search for the fountain of vascular youth. J Physiol. 2008;586(8):2041-2.
- Delp MD, Behnke BJ, Spier SA, Wu G, Muller-Delp JM. Ageing diminishes endothelium-dependent vasodilatation and tetrahydrobiopterin content in rat skeletal muscle arterioles. J Physiol. 2008;586(4):1161-8.
- Durante W, Johnson FK, Johnson RA. Аrginase: a critical regulator of nitric oxide synthesis and vascular function. Clin Exp Pharmacol Physiol. 2007;34(9): 906-11.
- Kovzun EI, Lukashenia OS, Pushkarev VM, Mikosha AS, Tronko MD. Effect of ions of potassium and lithium on NO synthase expression in the human adrenal cortex. Bull Exp Biol Med. 2014;156(3):332-4.
- Stojiljkovic M, Zakula Z, Koricanac G, Milosavljevic T, Tepavcevic S, Sudar E, et al. Regulation of cardiac nitric oxide synthase in acute type i diabetes: modulation of L-arginine availability and arginase activity. Adv Sci Lett. 2012;5(20);566-74.
- Sudar-Milovanovic E, Obradovic M, Jovanovic A, Zaric B, Zafirovic S, Panic A, et al. Benefits of L-arginine on cardiovascular system. Mini Rev Med Chem. 2016;16(2):94-103.
- Dobutovic B, Smiljanic K, Soskic S, Düngen H-D, Isenovic ER. Nitric oxide and its role in cardiovascular diseases. The Open Nitric Oxide J. 2011;3:65-71.
- Flammer AJ, Luscher TF. Three decades of endothelium research: from the detection of nitric oxide to the everyday implementation of endothelial function measurements in cardiovascular diseases. Swiss Med Wkly, 2010;140:w13122.
- Bode-Boger SM, Scalera F, Ignarro LJ. The L-arginine paradox: importance of the L-arginine/asymmetrical dimethylarginine ratio. Pharmacol Ther. 2007;114(3):295-306.
- Boger RH. The pharmacodynamics of L-arginine. J Nutr. 2007;137(6 Suppl 2):1650S-5S.
- Pretnar-Oblak J. Cerebral endothelial function determined by cerebrovascular reactivity to L-arginine. Biomed Res Int. 2014;2014:601515.
- Karlsson WK, Sørensen CG, Kruuse C. L-arginine and l-NMMA for assessing cerebral endothelial dysfunction in ischaemic cerebrovascular disease: A systematic review. Clin Exp Pharmacol Physiol. 2017;44(1):13-20.
- Czarnecka A, Aleksandrowicz M, Jasiński K, Jaźwiec R, Kalita K, Hilgier W, et al. Cerebrovascular reactivity and cerebral perfusion of rats with acute liver failure: role of L-glutamine and asymmetric dimethylarginine in L-arginine-induced response. J Neurochem. 2018;147(5):692-704.
- Andresen J, Shafi NI, Bryan RM Jr. Endothelial influences on cerebrovascular tone. J Appl Physiol. 2006;100(1):318-27.
- Ramchandra R, Hood SG, May CN. Central exogenous nitric oxide decreases cardiac sympathetic drive and improves baroreflex control of heart rate in ovine heart failure. Am J Physiol Regul Integr Comp Physiol. 2014;307:R271-80.
- Rajapakse NW, Head GA, Kaye DM. Say NO to obesity-related hypertension: role of the L-arginine-nitric oxide pathway. Hypertension. 2016;67(5):813-9.
- Biancardi VC, Son SJ, Sonner PM, Zheng H, Patel KP, Stern JE. Contribution of central nervous system endothelial nitric oxide synthase to neurohumoral activation in heart failure rats. Hypertension. 2011;58:454-63.
- Chen YC, Liu YC, Yen DH, Wang LM, Huang CI, Lee CH, et al. L-arginine causes amelioration of cerebrovascular dysfunction and brain inflammation during experimental heatstroke. Shock. 2008;29(2):212-6.
- Hu S, Han M, Rezaei A, Li D, Wu G, Ma X. L-arginine modulates glucose and lipid metabolism in obesity and diabetes. Curr Protein Pept Sci. 2017;18(6):599-608.
- Mittermayer F, Kautzky-Willer A, Winzer C, Krzyznowska K, Prikoszovich T, Demehri S, et al. Elevated concentrations of asymmetric dimethylarginine are associated with deterioration of glucose tolerance in women with previous gestational diabetes mellitus. I Intern Med. 2007;261:392-8.
- Das UN, Repossi G, Dain A, Eynard AR. L-arginine, NO and asymmetrical dimethylarginine in hypertension and type 2 diabetes. Front Biosci (Landmark Ed). 2011 1;16:13-20.
- Borucki K, Aronica S, Starke I, Luley C, Westphal S. Addition of 2.5g l-arginine in a fatty meal prevents the lipemia-induced endothelial dysfunction in healthy volunteers. Atherosclerosis. 2009;205(1):251-4.
- Dubó S, Gallegos D, Cabrera L, Sobrevia L, Zúñiga L, González M. Cardiovascular action of insulin in health and disease: endothelial L-Arginine transport and cardiac voltage-dependent potassium channels. Front Physiol. 2016;7:74.
- Hoang HH, Padgham SV, Meininger CJ. L-arginine, tetrahydrobiopterin, nitric oxide and diabetes. Curr Opin Clin Nutr Metab Care. 2013;16(1):76-82.
- Monti LD, Setola E, Lucotti PCG, Marrocco-Trischitta MM, Comola M, Galluccio E, et al. Effect of a long-term oral L-arginine supplementation on glucose metabolism: a randomized, double-blind, placebo-controlled trial. Diabetes Obes Metab. 2012;14:893-900.
- Dhar I, Dhar A, Wu L, Desai K. Arginine attenuates methylglyoxaland high glucose-induced endothelial dysfunction and oxidative stress by an endothelial nitric oxide synthase-independent mechanism. J Pharmacol Exp Therapeut. 2012;342:196-204.
- Assumpção CR, Brunini TM, Pereira NR, Godoy-Matos AF, Siqueira MA, Mann GE, et al. Insulin resistance in obesity and metabolic syndrome: is there a connection with platelet l-arginine transport? Blood Cells Mol Dis. 2010;45:338-42.
- Rajapakse NW, Karim F, Straznicky NE, Fernandez S, Evans RG, Head GA, et al. Augmented endothelial-specific L-arginine transport prevents obesity-induced hypertension. Acta Physiol (Oxf). 2014;212:39-48.
- Ettehad D, Emdin CA, Kiran A, Anderson SG, Callender T, Emberson J, et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and metaanalysis. Lancet. 2016;387(10022):957-67.
- da Cunha NV, Pinge-Filho P, Panis C, Silva BR, Pernomian L, Grando MD, et al. Decreased endothelial nitric oxide, systemic oxidative stress, and increased sympathetic modulation contribute to hypertension in obese rats. Am J Physiol Heart Circ Physiol. 2014;306: H1472-80.
- Hall JE, do Carmo JM, da Silva AA, Wang Z, Hall ME. Obesityinduced hypertension: interaction of neurohumoral and renal mechanisms. Circ Res. 2015;116:991-1006.
- Rondón LJ, Farges MC, Davin N, Sion B, Privat AM, Vasson MP, et al. L-Arginine supplementation prevents allodynia and hyperalgesia in painful diabetic neuropathic rats by normalizing plasma nitric oxide concentration and increasing plasma agmatine concentration. Eur J Nutr. 2018;57(7):2353-63. doi: 10.1007/s00394-017-1508-x.
- Head KA. Peripheral neuropathy: pathogenic mechanisms and alternative therapies. Altern Med Rev. 2006 Dec;11(4):294-329.
- El-Lithy GM, El-Bakly WM, Matboli M, Abd-Alkhalek HA, Masoud SI, Hamza M. Prophylactic L-arginine and ibuprofen delay the development of tactile allodynia and suppress spinal miR-155 in a rat model of diabetic neuropathy. Transl Res. 2016;177:85-97. e1. doi: 10.1016/j.trsl.2016.06.005.
- Deanfield JE, Halcox JP, Rabelink TJ. Endothelial function and dysfunction: testing and clinical relevance. Circulation. 2007;115(10):1285-95.
- Godo S, Shimokawa H. Endothelial functions. Arterioscler Thromb Vasc Biol. 2017;37(9):e108-14.
- Cylwik D, Mogielnicki A, Buczko W. L-arginine and cardiovascular system. Pharmacol Rep. 2005;57(1):14-22.
- Gambaryan S, Tsikas D. A review and discussion of platelet nitric oxide and nitric oxide synthase: do blood platelets produce nitric oxide from L-arginine or nitrite? Amino Acids. 2015;47(9):1779-93.
- Tan B, Li X, Yin Y, Wu Z, Liu C, Tekwe CD, et al. Regulatory roles for L-arginine in reducing white adipose tissue. Front Biosci (Landmark Ed). 2012;17:2237-46.
- Popovic PJ, Zeh HJ 3rd, Ochoa JB. Arginine and immunity. J Nutr. 2007;137(6, Suppl 2):1681S-6S.
- Szefel J, Danielak A, Kruszewski WJ. Metabolic pathways of L-arginine and therapeutic consequences in tumors. Adv Med Sci. 2019;64(1):104-10.
- Stechmiller JK, Childress B, Cowan L. Arginine supplementation and wound healing. Nutr Clin Pract. 2005;20(1):52-61.
- Zuchi C, Ambrosio G, Lüscher TF, Landmesser U. Nutraceuticals in cardiovascular prevention: lessons from studies on endothelial function. Cardiovasc Ther. 2010;28(4):187-201.
- López-Jaramillo P, Arenas WD, García RG, Rincon MY, López M. The role of the L-arginine-nitric oxide pathway in preeclampsia. Ther Adv Cardiovasc Dis. 2008;2(4):261-75.
- Fuhrmann J, Schmidt A, Spiess S, Lehner A, Turgay K, Mechtler K, et al. McsB is a protein arginine kinase that phosphorylates and inhibits the heat-shock regulator CtsR. Science. 2009;324:1323-7.
- Verma N, Singh AK, Singh M. L-arginine biosensors: A comprehensive review. Biochem Biophys Rep. 2017;12:228-39.