Эндотелиит в патогенезе хронической ИБС: клинические проявления и подходы к лечению

Резюме. Несмотря на то, что в последние годы в клинической практике активно внедрялись стратегии оптимизации профилактики и лечения ишемической болезни сердца (ИБС), последствия этого состояния все еще составляют значительное бремя для здоровья человека, удерживая ведущие позиции в структуре смертности и заболеваемости.
Этиология ишемии миокарда всесторонне изучается. Клинические, ангиографические и аутопсийные данные свидетельствуют о сложной патофизиологии ИБС, которая выходит за рамки общепринятой и упрощенной роли атеросклероза. В частности, существует гипотеза, что воспаление, влияя на эндотелиальные клетки (ЭК), стимулирует развитие и прогрессирование атеросклероза, а также вызывает острые тромботические осложнения. В то же время воспаление может быть не только причиной, но и следствием ИБС. В таком случае оно сначала охватывает миокард и только затем становится системным. Несомненно, важную роль в регуляции воспалительных реакций играет эндотелий.
Длительное влияние триггерных патофизиологических стимулов на клетки эндотелия является пусковым механизмом его провоспалительной активации с развитием эндотелиита, а в дальнейшем – эндотелиальной дисфункции, что приводит к хроническому нарушению регуляции микроциркуляции органов и тканей с последующим развитием ишемических осложнений.
В статье раскрывается роль эндотелиита и эндотелиальной дисфункции в патогенезе ИБС, демонстрируются клинические последствия, а также приводятся возможности усиления патогенетического лечения.
Ключевые слова: ишемическая болезнь сердца, стенокардия, эндотелиит, эндотелиальная дисфункция, L-аргинин, L-карнитин.
Статья. Несмотря на то что в последние годы в клинической практике активно внедрялись стратегии оптимизации профилактики и лечения ишемической болезни сердца (ИБС), последствия этого состояния все еще составляют значительное бремя для здоровья человека, удерживая ведущие позиции в структуре смертности и заболеваемости. Этиология ишемии миокарда всесторонне изучается. Клинические, ангиографические и аутопсийные данные свидетельствуют о сложной патофизиологии ИБС, которая выходит за рамки общепринятой и упрощенной роли атеросклероза. В частности, существует гипотеза, что воспаление, влияя на эндотелиальные клетки (ЭК), стимулирует развитие и эволюцию атеросклероза, а также вызывает острые тромботические осложнения. В то же время воспаление может быть не только причиной, но и следствием ИБС. В таком случае оно сначала охватывает миокард и только затем становится системным. Несомненно важную роль в регуляции воспалительных реакций играет эндотелий. Длительное влияние триггерных патофизиологических стимулов на клетки эндотелия является пусковым механизмом его провоспалительной активации с развитием эндотелиита, а в дальнейшем – эндотелиальной дисфункции, что приводит к хроническому нарушению регуляции микроциркуляции органов и тканей с последующим развитием ишемических осложнений.
Эндотелиит как причина и следствие хронической ИБС
Ишемическая болезнь сердца (ИБС) – это патологический процесс, который в большинстве случаев характеризуется развитием атеросклеротических бляшек в эпикардиальных артериях; в его основе лежит нарушение кровотока в сосудах сердца, что приводит к недостаточному кровоснабжению сердечной мышцы. ИБС является хроническим и, как правило, прогрессирующим заболеванием даже при стабильном клиническом течении [1]. Несомненно важную роль в развитии и клинических проявлениях атеросклеротического поражения сосудов сердца как одного из ведущих этиологических факторов ИБС играют воспаление эндотелия (эндотелиит) и эндотелиальная дисфункция. Известно, что специфическое распознавание антигенов рецепторами иммунной системы инициирует местный воспалительный ответ против патогенов или тканей самого хозяина. Воспалительные реакции обычно адаптивны и уничтожают возбудителя или способствуют гомеостазу, стимулируя удаление фагоцитами поврежденной ткани и мертвых клеток. И наоборот, чрезмерный по интенсивности или длительности воспалительный ответ может быть патогенным и вызвать усиление местного повреждения ткани: именно такой дезадаптивный воспалительный процесс обусловливает развитие эндотелиита и дисфункции эндотелия, вызывая тем самым расстройства эндотелиальной регуляции сосудистого тонуса, а также может быть движущим фактором в инициации и прогрессировании атеросклероза, как следствие – ИБС [2, 3].
Эндотелиальная дисфункция – ключевой момент в патогенезе атеросклероза, в то время как атеросклероз – клиническое проявление эндотелиальной дисфункции [4-6]. Как известно, изменения в эндотелиальном монослое происходят еще на ранних стадиях атерогенеза [7]. Однако эндотелиит и эндотелиальная дисфункция не только участвуют в развитии ИБС, предшествуя атерогенезу, но и играют важную роль в дальнейшем прогрессировании атеросклероза и ИБС, о чем, в частности, свидетельствует повышение уровня маркеров системного воспаления, таких как С-реактивный протеин, фактор некроза опухоли альфа (ФНО-α), интерлейкин-1β, интерлейкин-6 и интерлейкин-8, в системном кровотоке пациентов с ИБС, а также доказанная связь повышенных уровней этих маркеров со степенью поражения коронарного русла и дестабилизацией течения заболевания [8, 9]. В исследовании, проведенном P. Severino и соавт., было установлено, что локальное воспаление влияет на продукцию некоторых протеолитических ферментов, что способствует разрыву атеросклеротической бляшки [10]. Кроме того, эндотелиит и эндотелиальная дисфункция считаются независимыми предикторами развития рестенозов после интервенционных вмешательств у пациентов с ИБС, что было продемонстрировано в исследовании Wang и соавт. [11, 12].
Факторы риска развития эндотелиита
В настоящее время одними из основных антигенов иммунного ответа при развитии атеросклероза считаются окисленные липопротеины низкой плотности (ЛПНП) [13, 14], которые играют фундаментальную роль во всем процессе атерогенеза, начиная от образования бляшек и заканчивая их дестабилизацией. Окисленные ЛПНП повышают экспрессию аргиназы и снижают уровень эндотелиальной NO-синтазы (eNOS) в эндотелиоцитах, тем самым способствуя уменьшению продукции оксида азота (NO), стимулируют образование активных форм кислорода (АФК) и усиливают адгезию моноцитов к активированным ЭК, чем обусловливают развитие эндотелиита и эндотелиальной дисфункции [15, 16]. Кроме того, окисленные ЛПНП могут индуцировать миграцию и пролиферацию гладкомышечных клеток сосудов (VSMC), активируют сигнальные пути SR/TLR (Toll-подобный рецептор) в макрофагах, что приводит к индукции провоспалительных цитокинов, в частности интерлейкина-1β, путем активации цитозольного протеина Nod-подобного рецептора (NLRP3), а также продукции АФК. Окисленные ЛПНП могут индуцировать апоптоз и некроз сосудистых ЭК, VSMC и макрофагов [17-20]. Следовательно, повышенные уровни окисленных ЛПНП связаны с нестабильностью бляшек и положительно коррелируют с тяжестью ишемии миокарда при атеросклеротическом поражении венечных артерий [21]. Эти процессы модулируются избыточной экспрессией лектиноподобных окисленных ЛПНП-рецепторов-1 (LOX-1) ЭК. ЭК усиливают экспрессию LOX-1 в ответ на стимуляцию окисленных ЛПНП провоспалительными цитокинами и проатерогенными факторами, такими как ангиотензин II. На конечных этапах атерогенеза окисленные ЛПНП становятся причиной развития апоптотической смерти ЭК, возможно, именно из-за чрезмерной экспрессии LOX‑1.
LOX‑1 важны для эндотелиально-опосредованного сосудистого гомеостаза и предотвращения свертывания крови в физиологических условиях [12]. Модуляция LOX‑1 окисленными ЛПНП приводит к избыточной выработке супероксид-анионов. В присутствии NO они обусловливают образование пероксинитрита (ONOO—) – высокореактивного токсического окислителя ЭК, вызывающего апоптоз клеток [22].
К другим факторам риска, причинно связанным с атеросклерозом и, соответственно, с развитием ИБС, относятся артериальная гипертензия, курение, гипергликемия, ожирение и метаболический синдром. Хотя механизмы, которые связывают эти факторы риска с атерогенезом, остаются не до конца выясненными, все они также влияют на развитие дисбаланса оксидантно-антиоксидантной системы и участвуют в активации воспалительных путей, обусловливая развитие эндотелиита. Как следствие, влияние атерогенных факторов риска, в том числе рассмотренных выше, препятствует выработке ЭК эндогенных вазодилататоров, в частности NO [23], что способствует развитию эндотелиальной дисфункции.
Механизмы развития эндотелиита
Эндотелий как полноценный орган играет важную роль в регуляции воспалительных реакций. Он не только служит физическим барьером, который ограничивает поток веществ и жидкости в ткани и из них, но также выступает ключевым игроком в регуляции гомеостаза сосудистого тонуса путем высвобождения вазодилатирующих факторов, таких как NO и простациклин, и вазоконстрикторных факторов, таких как эндотелин-1 и тромбоксан А2 [24-26]. Эндотелий является источником широкого спектра факторов, локально регулирующих проницаемость, рост и миграцию клеток, функцию тромбоцитов и воспаления [24, 27]. Поскольку воспаление в решающей степени включает адгезию, проницаемость сосудов и инфильтрацию иммунных клеток, а также активацию этих инфильтрированных иммунных клеток [28], становится ясно, что активация ЭК может вызвать воспаление сосудов и в конечном итоге тканей.
В физиологических условиях благодаря выработке NO и простациклина (PGI2) лейкоциты не могут длительно прилипать к эндотелию. Под действием воспаления значительно изменяется взаимодействие между эндотелием и лейкоцитами, что приводит к экспрессии ЭК молекул адгезии, которые связываются с лейкоцитами, сохраняя и усиливая местную воспалительную реакцию [10].
Известно, что эндотелий реагирует на воспаление повышением проницаемости, расширением сосудов, нарастанием диапедеза лейкоцитов, коагуляции и тромбообразования. Механизм стимуляции эндотелия зависит от триггерного агента и обычно связан с выбросом ряда медиаторов воспаления и мобилизации содержимого гранул ЭК на клеточной поверхности [29, 30]. Когда возникает необходимость более устойчивой и эффективной регуляции воспалительного процесса, реализуется следующая стадия эндотелиального ответа, основным механизмом которого является цитокинзависимая активация плейотропных факторов транскрипции, таких как ядерный фактор κB (NF-κB), влияющий на экспрессию генов и синтез белков [31]. Стимуляция эндотелия, происходящая под действием повреждающих факторов и медиаторов воспаления, опосредуется рецепторами, связанными с G-протеином (GPCR), является временной и не приводит к устойчивым морфологическим и функциональным изменениям.
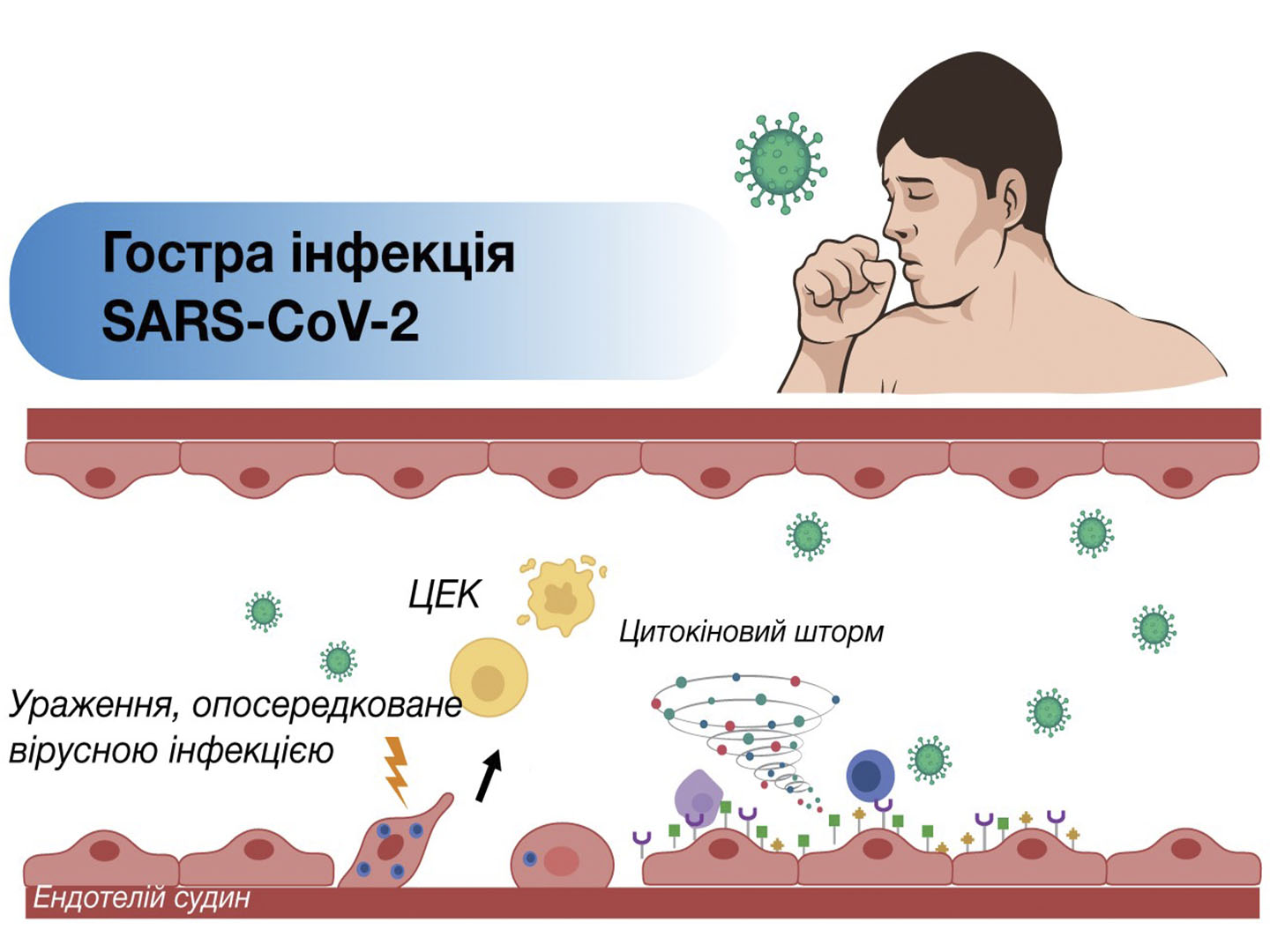
Однако ЭК имеют определенный физиологический лимит адаптивной реакции на действие стимулов различного генеза, превышение которого непременно влечет за собой повреждение эндотелия и развитие его воспаления – эндотелиита [32]. Развитие эндотелиита является следствием как прямой инвазии инфекционных патогенов, так и иммунного ответа хозяина [33]. Термин «эндотелиит» первоначально использовался для описания патологического процесса роговицы, который классически проявляется ее отеком и наличием воспалительных клеточных отложений, или преципитатов. Однако позже было установлено, что эндотелиит также может развиваться вследствие оксидативного стресса, влияния цитокинов, ишемии/гипоксии тканей, дислипопротеинемии, эндогенной и экзогенной интоксикации, возрастных изменений и других патологических процессов, возникающих на фоне артериальной гипертензии, действия поллютантов сигаретного дыма, старения, а также инфекций, в том числе вирусных [34-36]. Прямое поражение эндотелиоцитов вирусами или их опосредованное повреждение иммунными клетками, цитокинами и свободными радикалами может привести к выраженной дисфункции эндотелия, что, в свою очередь, приводит к нарушению микроциркуляции и вазоконстрикции с дальнейшим развитием ишемии органов, воспаления, отека тканей и гиперкоагуляции [37].
В частности, в ряде исследований продемонстрировано, что сосудистый эндотелиит обусловливает системное воспаление и коагулопатию, являющиеся ключевыми звеньями патогенеза острого респираторного дистресс-синдрома, полиорганной недостаточности и синдрома диссеминированного внутрисосудистого свертывания при коронавирусной болезни (COVID-19). Кроме того, по данным J. Seeßle и соавт. (2021), через 12 мес после COVID‑19 к нормальному уровню здоровья полностью вернулись только 22,9% пациентов [40]. Было установлено, что биохимические и воспалительные пути в организме могут оставаться нарушенными в течение длительного времени после стихания инфекции SARS-CoV-2 даже у бессимптомных и умеренно пораженных пациентов [41]. Считается, что сохраняющийся после острой фазы эндотелиит становится одной из главных причин клинических симптомов Long COVID [42].
Изменения ЭК регистрировали и в случае их инфицирования другими вирусными агентами, в частности вирусами простого герпеса 1 и 2 типов, вирусом Эпштейна – Барр, цитомегаловирусом, вирусом герпеса 6 типа и вирусом гриппа типа А [43-45]. Такие изменения ЭК характеризуются снижением активности натриевой помпы, повреждением плотных межклеточных контактов, активацией выработки цитокинов (ФНО-α, ИЛ‑6, 10 и 1β, TLR4, эндотелиального фактора роста сосудов и CXCL8), выраженным снижением экспрессии eNOS и модуляцией экспрессии ингибитора активации плазминогена 1 типа (PAI-1). Эти внутриклеточные изменения сопровождаются значительным увеличением проницаемости эндотелиального барьера, активацией микротромбообразования и тяжелым течением воспалительного процесса [46, 47].
Последствия эндотелиита при ИБС
Системное повреждение эндотелия, эндотелиит, является причиной его ремоделирования – устойчивого изменения структуры и функции, что приводит к потере контролирующих воздействий ЭК с формированием выраженного снижения сосудистого тонуса, диффузного изменения перфузии тканей, генерализованного повышения проницаемости и гиперкоагуляции [48].
Способность эндотелия регулировать сосудистый гомеостаз в значительной степени зависит от продукции NO, синтезируемого из L-аргинина под действием NOS и ряда коферментов. Окисленные ЛПНП повышают экспрессию аргиназ и, соответственно, снижают биодоступность аргинина для NOS, способствуя уменьшению продукции NO, что является основным фактором, который лежит в основе дисфункции эндотелия [49]. На фоне понижения уровня NO в тканях сердца повышается тонус коронарных сосудов и снижается венечный кровоток. Кроме регуляции сосудистого тонуса, NO выполняет ряд других функций, а именно снижает адгезию и агрегацию тромбоцитов, адгезию лейкоцитов, предотвращает пролиферацию гладких мышц, тормозит процессы ремоделирования сосудистой стенки, снижает выделение провоспалительных цитокинов, ингибирует экспрессию молекулы клеточной адгезии ICAM‑1 (молекулы межклеточной адгезии 1 типа), VCAM‑1 (молекулы адгезии сосудистого эндотелия 1 типа) и тканевого фактора, ингибирует выделение хемокинов, таких как MCP‑1, подавляет образование комплексов окисленных ЛПНП, предупреждает вазоконстрикторные эффекты тромбоксана А2, серотонина, которые выделяются из тромбоцитов, снижает стабильность мРНК, моноцитарного хемотаксического фактора, подавляет экспрессию провоспалительных генов (NF-κB) и обладает ангиопротекторными свойствами, что делает недостаточность NO основным признаком эндотелиальной дисфункции [50, 51]. Таким образом, формируется цепочка: эндотелиит – эндотелиальная дисфункция – дефицит NO – запуск развития атеросклероза – ишемия и гипоксия кардиомиоцитов.
Дисфункция эндотелия с дефицитом NO, повышением экспрессии факторов роста, локальных вазоактивных веществ, протеинов и протеиназ матрикса приводит к сосудистому ремоделированию, повреждению структуры сосуда, адгезии моноцитов, что является причиной прогрессирования атеросклероза [4].
Следствием дисфункции эндотелия с нарушением эндотелийзависимого венечного кровотока является развитие гипоксии и ишемии миокарда [52]. Кроме того, атеросклероз коронарных артерий оказывает непосредственное влияние на баланс и потребность снабжения миокарда кислородом, а также является фактором, составляющим 90% эпизодов ишемии миокарда [53].
Как известно, оптимальным источником энергии для кардиомиоцитов является окисление жирных кислот. В условиях гипоксии и ишемии нарушается снабжение кислородом и питательными веществами в кардиомиоцитах, поэтому они вынуждены переключаться на анаэробный гликолиз, который позволяет им выжить. При этом в процессе окисления 1 молекулы глюкозы образуется 38 молекул АТФ, тогда как в случае окисления наиболее распространенных жирных кислот – стеариновой и пальмитиновой – может образоваться по 138 молекул АТФ. Итак, сердце при ИБС – мотор без топлива. Именно поэтому патогенетически обосновано применение препаратов, которые влияют на энергетический обмен миокарда и восстанавливают его нормальный окислительный путь синтеза АТФ [54].
Лечение эндотелиита при ИБС
Уменьшение проявлений эндотелиита при ИБС
Потенциально эффективным подходом к коррекции дисфункции эндотелия, возникающей на фоне эндотелита, является восстановление нормального уровня синтеза NO, в частности путем предоставления дополнительных субстратов для NOS. Таким субстратом является L-аргинин – условно незаменимая аминокислота, которая, будучи предшественником NO, играет важную роль в регуляции сосудистого тонуса и сердечно-сосудистого гомеостаза в целом [51, 55]. Повышение биодоступности NO не только обеспечивает эндотелийзависимую вазодилатацию, но и уменьшает активацию провоспалительных генов и экспрессию молекул эндотелиальной адгезии, влияя таким образом на атерогенез [55].
Эффективность применения L-аргинина в дозе 2 г 3 р/сут в течение 4 недель для лечения пациентов со стабильной стенокардией I-II функциональных классов (ФК) была доказана в исследовании A. Palloshi и соавт., в котором продемонстрировали его способность к снижению ФК стенокардии, систолического артериального давления (АД) в покое, улучшению качества жизни, повышению концентрации L-аргинина и циклического гуанозинмонофосфата [56].
В проспективном двойном слепом рандомизированном перекрестном исследовании, проведенном M.R. Adams и соавт., пероральный прием L-аргинина в дозе 21 г/сут в течение 3 дней способствовал значительному улучшению эндотелийзависимой вазодилатации и снижению адгезии моноцитов к эндотелию (с 50±1 до 42±2%; p<0,01) у больных с ангиографически подтвержденным коронарным атеросклерозом [57].
В дальнейшем в рандомизированном двойном слепом плацебо-контролируемом перекрестном исследовании с двумя периодами лечения (аргинин/плацебо) продолжительностью 2 недели каждый было продемонстрировано, что назначение аргинина способствует улучшению эндотелийзависимой вазодилатации плечевых артерий, толерантности к физическим нагрузкам и качества жизни пациентов со стабильной стенокардией напряжения II-III ФК. В частности, максимальная вазодилатация плечевых артерий в группе аргинина значительно возросла по сравнению с исходным уровнем (8,0±4,9 против 5,5±4,5 соответственно; p=0,004), в то время как в группе плацебо динамики тонуса сосудов не отмечено (5,8±5,3 против 5,8±6,4 до и после назначения плацебо соответственно; p=0,95). Время выполнения нагрузки увеличилось на 16% в период лечения по сравнению с уменьшением на 4% во время периода плацебо (р=0,05). Кроме того, в группе аргинина наблюдалось достоверное улучшение качества жизни, оцененное в соответствии с опросником SF‑36 (68±13 баллов в группе лечения против 63±21 балл в группе плацебо; р=0,04) [58]. Результаты двойного слепого плацебо-контролируемого исследования, включавшего 22 пациента со стабильной стенокардией, свидетельствуют об улучшении толерантности к физической нагрузке всего за 3 дня приема аргинина [59].
L-аргинин доказал свою эффективность при включении в комплексную терапию ишемии миокарда. В частности, введение L-аргинина в дозе 3 г/сут в течение 15 дней обеспечивало повышение активности фермента супероксиддисмутазы, поглощающего свободные радикалы, и увеличение уровней общих тиолов и аскорбиновой кислоты с сопутствующим снижением перекисного окисления липидов, содержания карбонилов, сывороточного холестерина и активности прооксидантного фермента ксантиноксидазы [60]. В исследовании W.H. Yin и соавт. у 31 пациента со стабильной ИБС пероральный прием L-аргинина в дозе 10 г/сут в течение 4 недель способствовал улучшению эндотелиальной функции и снижению окисления ЛПНП [61].
Метаболизм NO в организме является цикличным: NO может образовываться не только путем синтеза из аргинина, но и путем его восстановления из нитрит-иона – продукта аутоокисления NO и основного резервуара NO в циркуляции. В этом аспекте еще одним важным эффектом аргинина является влияние на функцию почек, а именно на выведение нитритов с мочой. В плацебо-контролируемом исследовании, проведенном J.Y. Schneider и соавт., пероральное введение аргинина в дозе 10 г/сут в течение 3-6 месяцев предотвращало потерю биоактивности NO путем увеличения реабсорбции нитрита в почечных канальцах [62].
Недавно выполненный систематический обзор подтвердил положительный эффект добавок аргинина в дозе 3 г/сут при его применении у пациентов с сердечно-сосудистыми нарушениями, особенно для предотвращения прогрессирования артериальной гипертензии и атеросклероза. Существует мнение, что атеросклероз обусловлен недостатком L-аргинина, вероятнее всего, вследствие нарушения взаимосвязи между лизином и L-аргинином и взаимодействия между метаболизмом эстрогена и L-аргинина [18]. Аргинин в дозе 3 г/сут способствовал синтезу NO без развития токсических эффектов [51].
Устранение последствий эндотелтиита при ИБС – гипоксии миокарда
L-карнитин (3-гидрокси‑4-N, N, N-триметиламинобутират) – это модифицированная витаминоподобная аминокислота, которая играет важную роль в поддержании энергетического обеспечения организма. Роль L-карнитина в энергетическом обмене миокарда заключается в способности содействовать переносу свободных жирных кислот внутрь митохондрий, обеспечивая таким образом окислительный метаболизм в кардиомиоците и способствуя нормальному функционированию левого желудочка [63, 64]. Кроме того, L-карнитин стимулирует удаление из митохондрий продуктов окисления жиров и других недоокисленных веществ, что отмечается во время ишемических событий и может привести к роковым желудочковым аритмиям [65].
Согласно результатам метаанализа, включавшего 13 плацебо-контролируемых исследований, применение L-карнитина снижало риск смерти от всех причин на 27%, желудочковых аритмий – на 65% и стенокардии – на 40% [66].
Результаты еще одного метаанализа 17 рандомизированных контролируемых исследований, проведенного X. Song и соавт. (2017), подтвердили безопасность и эффективность применения L-карнитина у пациентов с хронической сердечной недостаточностью. L-карнитин способствовал значительному повышению общей эффективности, фракции выброса левого желудочка, ударного объема (8,21 мл), сердечного выброса (0,88 л/мин), а также уменьшению размеров левого желудочка и снижению уровней BNP (-124, 60 пг/мл) и NT-proBNP (-510,36 пг/мл) в сыворотке крови [63].
Кроме того, L-карнитин способствует снижению уровней общего холестерина, ЛПНП и триглицеридов, а также повышению содержания липопротеинов высокой плотности, что было продемонстрировано в метаанализе 55 рандомизированных контролируемых исследований [67].
L-карнитин обладает антиоксидантными и противовоспалительными свойствами. Он является прямым антиоксидантом и удаляет уже образовавшиеся радикалы кислорода и ингибирует генерацию радикалов кислорода цитозольными и мембраносвязанными ферментами вследствие образования комплексов с ионами железа и меди в их активных центрах, а также влияет на функциональную активность провоспалительных клеток [68]. L-карнитин снижает экспрессию индуцибельного белка NOS (iNOS) – провоспалительного фермента, генерирующего большое количество радикалов NO, оказывающих цитотоксическое действие на чужеродные и собственные клетки человека; тормозит активность NF-κB, снижает экспрессию провоспалительных цитокинов ФНО-α и ИЛ‑6 и увеличивает экспрессию защитного белка PPARα, а также блокирует развитие апоптоза по этому механизму [68, 69].
Тиворель® – эндотелиопротектор и антигипоксант в одном флаконе, применение которого является патогенетически обоснованным для лечения пациентов с ИБС. В случае хронической ИБС рекомендована такая схема применения раствора Тиворель®: 1 флакон внутривенно капельно 1 р/сут 10 дней с последующим переходом на пероральный Тивортин аспартат по 2 мерные ложки 2 р/сут до 2 месяцев.
Благодаря комплексному составу (2,0 г левокарнитина и 4,2 г L-аргинина гидрохлорида) Тиворель® улучшает энергообеспечение сердечной мышцы, усиливает окисление углеводов в цикле трикарбоновых кислот, обеспечивает антиоксидантное, антигипоксическое действие, уменьшает проявления эндотелиита и улучшает эндотелиальную функцию, предотвращает развитие и прогрессирование атеросклеротических бляшек.
Украина входит в число стран с очень высоким риском развития сердечно-сосудистой патологии, следствием чего является снижение трудоспособности и рост уровня инвалидности у лиц трудоспособного возраста. В этом аспекте важное значение придают своевременному выявлению категории лиц с высоким кардиоваскулярным риском и проведению надлежащих профилактических мероприятий в этой группе пациентов. Инструментом, который помогает клиницистам оценить риск развития сердечно-сосудистого события (фатального или нефатального) в ближайшие 10 лет у условно здоровых лиц (отсутствие сердечно-сосудистой патологии, стентирования/шунтирования коронарных сосудов, сахарного диабета, высокого уровня общего холестерина или его фракций, семейной гиперхолестеринемии, очень высокого уровня АД (систолическое АД – до 179 мм рт. ст.), хронической болезни почек) в возрасте 40-69 лет, имеющих факторы риска, является шкала SCORE2 (Systematic COronary Risk Estimation-2). Оценка сердечно-сосудистого риска по шкале SCORE2 производится по 5 параметрам, а именно пол, возраст, статус курения, уровень АД и общего холестерина в ммоль/л. Если пол и возраст являются факторами, которые не поддаются модификации, то на остальные три – курение, уровень АД и общего холестерина – влиять необходимо. В частности, всем пациентам рекомендуются отказ от курения, коррекция повышенного АД и дислипидемии [70].
Следует отметить, что эти три фактора риска воспринимаются в контексте развития эндотелиальной дисфункции. Именно поэтому целесообразно назначение раствора Тиворель® для коррекции проявлений эндотелиальной дисфункции и профилактики развития кардиоваскулярных событий пациентам высокого риска в соответствиисо шкалой SCORE2.
Авторы: Тащук В. К., д.м.н., профессор, заведующий кафедрой внутренней медицины, физической реабилитации и спортивной медицины Буковинского государственного медицинского университета, г. Черновцы, Украина.
Литература:
- Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги (УКПМД) «Стабільна ішемічна хвороба серця»,2021
- Libby, P., Buring, J. E., Badimon, L., Hansson, G. K., Deanfield, J., Bittencourt, M. S., … Lewis, E. F. (2019). Atherosclerosis. Nature Reviews Disease Primers, 5(1). doi:10.1038/s41572-019-0106-z 10.1038/s41572-019-0106-z
- Ammirati, E.; Moroni, F.; Magnoni, M.; Camici, P.G. The role of T and B cells in human atherosclerosis and atherothrombosis. Clin. Exp. Immunol. 2015, 179, 173–187.
- В.О. Шумаков, Атеросклероз як клінічний прояв ендотеліальної дисфункції. Медична газета «Здоров’я України 21 сторіччя», тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» 2020
- Gary H. Gibbons,Endothelial function as a determinant of vascular function and structure: A new therapeutic target, The American Journal of Cardiology, Volume 79, Issue 5, Supplement 1, 1997,Pages 3-8, ISSN 0002-9149, org/10.1016/S0002-9149(97)00122-7. № 1 (68), 2020 р
- О. А. Воробьева Терапевтические эффекты метаболитотропного кардиопротектора, содержащего L-аргинин и инозин, у больных пожилого и старческого возраста с ИБС. Патологія. 2012. 2. 98-101.
- Бабак, О.Я., Молодан, В.І. Просоленко, К.О.Железнякова, Н.М.Андреева, А.О.Зелена, І.І. Оптимізація діагностики функціонального стану ендотелію у хворих на гіпертонічну хворобу у поєднанні з ожирінням, методичні рекомендації 2014. repo.knmu.edu.ua/handle/123456789/9992
- Кравчун, П., Шелест, М., Ковальова, Ю., Шелест, Б., & Риндіна, Н. (2013). Особливості змін маркерів запалення у хворих на ішемічну хворобу серця з ожирінням. Медицина сьогодні і завтра, 59(2), 38-42. msz.knmu.edu.ua/article/view/145.
- В.І. Денисюк, О.В. Ковальчук, О.В. Денисюк. Ендотеліальна функція судин при ішемічній хворобі серця у поєднанні з артеріальною гіпертензією Практична ангіологія. 2008 6(17).
- Severino, P.; D’Amato, A.; Pucci, M.; Infusino, F.; Adamo, F.; Birtolo, L.I.; Netti, L.; Montefusco, G.; Chimenti, C.; Lavalle, C.; Maestrini, V.; Mancone, M.; Chilian, W.M.; Fedele, F. Ischemic Heart Disease Pathophysiology Paradigms Overview: From Plaque Activation to Microvascular Dysfunction. Int. J. Mol. Sci. 2020, 21, 8118. doi.org/10.3390/ijms21218118
- Аксьонов Є. В. Ендотеліальна дисфункція та шляхи її профілактики при проведенні рентгенендоваскулярних процедур по реканалізації коронарних артерій. Український журнал медицини, біології та спорту – Том 4, № 5 (21) doi: 10.26693/jmbs04.05.102
- Wang K, Zuo G, Zheng L, Zhang C, Wang D, Cao Z, et al. Effects of tirofiban on platelet activation and endothelial function in patients with ST-elevation myocardial infarction undergoing primary percutaneous coronary intervention. Cell Biochem Biophys. 2015; 71(1): 135-42. PMID: 25123839. DOI: 10.1007/s12013-014-0173-4
- Steinberg, D. Atherogenesis in perspective: Hypercholesterolemia and inflammation as partners in crime. Nat. Med. 2002, 8, 1211–1217. [Google Scholar] [CrossRef] [PubMed]
- Suzuki, T.; Kohno, H.; Hasegawa, A.; Toshima, S.; Amaki, T.; Kurabayashi, M.; Nagai, R.; Suzuki, T.; Amaki, T.; Nagai, R.; et al. Diagnostic implications of circulating oxidized low density lipoprotein levels as a biochemical risk marker of coronary artery disease. Clin. Biochem. 2002, 35, 347–353. [Google Scholar] [CrossRef]
- Mehta, J.L.; Li, D. Identification, regulation and function of a novel lectin-like oxidized low-density lipoprotein receptor. J. Am. Coll. Cardiol. 2002, 39, 1429–1435. [Google Scholar] [CrossRef][Green Version]
- Chen, M.; Masaki, T.; Sawamura, T. LOX-1, the receptor for oxidized low-density lipoprotein identified from endothelial cells: Implications in endothelial dysfunction and atherosclerosis. Pharmacol. Ther. 2002, 95, 89–100. [Google Scholar] [CrossRef]
- Prinzmetal, M.; Kennarner, R.; Merliss, B.; Wads, T.; Bor, N. Angina pectoris. I. A variant form of angina pectoris; preliminary report. Am. J. Med. 1959, 27, 375–388. [Google Scholar] [CrossRef]
- Maseri, A. Mechanisms of myocardial ischemia. Cardiovasc. Drugs Ther. 1990, 4 (Suppl. 4), 827–831. [Google Scholar] [CrossRef]
- Wu, N.; Li, W.; Shu, W.; Lv, Y.; Jia, D. Inhibition of Rho-kinase by fasudil restores the cardioprotection of ischemic postconditioninng in hypercholesterolemic rat heart. Mol. Med. Rep. 2014, 10, 2517–2524. [Google Scholar] [CrossRef][Green Version]
- Liuzzo, G.; Biasucci, L.M.; Gallimore, J.R.; Grillo, R.L.; Rebuzzi, A.G.; Pepys, M.B.; Maseri, A. The prognostic value of C-reactive protein and serum amyloid a protein in severe unstable angina. N. Engl. J. Med. 1994, 331, 417–424. [Google Scholar] [CrossRef] [PubMed]
- Ehara, S.; Ueda, M.; Naruko, T.; Haze, K.; Itoh, A.; Otsuka, M.; Komatsu, R.; Matsuo, T.; Itabe, H.; Takano, T.; et al. Elevated levels of oxidized low density lipoprotein show a positive relationship with the severity of acute coronary syndromes. Circulation 2001, 103, 1955–1960. [Google Scholar] [CrossRef]
- Mollace, V.; Gliozzi, M.; Musolino, V.; Carresi, C.; Muscoli, S.; Mollace, R.; Tavernese, A.; Gratteri, S.; Palma, E.; Morabito, C.; et al. Oxidized LDL attenuates protective autophagy and induces apoptotic cell death of endothelial cells: Role of oxidative stress and LOX-1 receptor expression. Int. J. Cardiol. 2015, 184, 152–158. [Google Scholar] [CrossRef] [PubMed]
- Saenz-Medina J, Muñoz M, Rodriguez C, Sanchez A, Contreras C, Carballido-Rodríguez J, Prieto D. Endothelial Dysfunction: An Intermediate Clinical Feature between Urolithiasis and Cardiovascular Diseases. Int J Mol Sci. 2022 Jan 14;23(2):912. doi: 10.3390/ijms23020912. PMID: 35055099; PMCID: PMC8778796
- Hattori Y, Hattori K, Machida T, Matsuda N. Vascular endotheliitis associated with infections: Its pathogenetic role and therapeutic implication. Biochem Pharmacol. 2022 Mar;197:114909. doi: 10.1016/j.bcp.2022.114909. Epub 2022 Jan 10. PMID: 35021044; PMCID: PMC8743392.
- Busse, I. Fleming, Vascular endothelium and blood flow, Handb. Exp. Pharmacol. 176 (pt 2) (2006) 43–78.
- Godo, H. Shimokawa, Endothelial functions, Arterioscler. Thromb. Vasc. Biol. 37 (9) (2017) e108–e114.
- Krüger-Genge, A. Blocki, R.-P. Franke, F. Jung, Vascular endothelial cell biology: an update, Int. J. Mol. Sci. 20 (2019) 4411.
- Davey MP, Martin TM, Planck SR, Lee J, Zamora D, Rosenbaum JT: Human endothelial cells express NOD2/CARD15 and increase IL-6 secretion in response to muramyl dipeptide. Microvasc Res 2006, 71(2):103–107
- Krausgruber T, Fortelny N, Fife-Gernedl V et al.Structural cells are key regulators of organ-specific immune responses // Nature. 2020;583(7815):296–302. Doi: 10.1038/s41586-020-2424-4.
- Armingol E, Officer A, Harismendy O, Lewis NE.Deciphering cell-cell interactions and communication from gene expression // Nat. Rev. Genet. 2021;22(2):71–88. Doi: 10.1038/s41576-020-00292-x.
- Kircheis R, Haasbach E, Lueftenegger D, Heyken WT, Ocker M, Planz O. NF-κB Pathway as a Potential Target for Treatment of Critical Stage COVID-19 Patients. Front Immunol. 2020 Dec 10;11:598444. doi: 10.3389/fimmu.2020.598444. PMID: 33362782; PMCID: PMC7759159.
- Приходько-Дибська К. COVID‑19: результати аутопсії [Електронний ресурс] / Режим доступу: www.umj.com.ua/article/183365/covid‑19-rezultati-autopsiyi
- Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, Mehra MR, Schuepbach RA, Ruschitzka F, Moch H. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020 May 2;395(10234):1417-1418. doi: 10.1016/S0140-6736(20)30937-5. Epub 2020 Apr 21. PMID: 32325026; PMCID: PMC7172722.
- Suzuki T, Ohashi Y. Corneal endotheliitis. Semin Ophthalmol. 2008 Jul-Aug;23(4):235-40. doi: 10.1080/08820530802111010. PMID: 18584561.
- Chudek J. Adipose tissue, inflammation and endothelial dysfunction / J. Chudek, A. Wiecek // Pharmacological Reports. – 2006. – Vol. 58, Suppl. – P. 81-88
- Versari D. Endothelial dysfunction as a target for preventation of cardiovascular disease / D. Versari, E. Daghini, A. Virdis // Diabetes Care. – 2009. – Vol. 32. – P. 314-321.
- Т.О. Проскура.Потенційні органи-мішені постковідного синдрому. ЖУРНАЛ НЕВРОЛОГІЇ ім. Б.М. Маньковського’ 2021, ТОМ 9, № 1-2 neuroscience.com.ua/index.php/journal/article/download/372/303/
- Becker RC. COVID-19-associated vasculitis and vasculopathy // J. Thromb. Thrombolysis. 2020;50(3):499–511.
- McGonagle D, Bridgewood C, Ramanan AV, Meaney JFM, Watad A. COVID-19 vasculitis and novel vasculitis mimics // Lancet Rheumatol. 2021;3(3):e224–e233.
- Seeßle J, Waterboer T, Hippchen T, Simon J, Kirchner M, Lim A, Müller B, Merle U. Persistent Symptoms in Adult Patients 1 Year After Coronavirus Disease 2019 (COVID-19): A Prospective Cohort Study. Clin Infect Dis. 2022 Apr 9;74(7):1191-1198. doi: 10.1093/cid/ciab611. PMID: 34223884; PMCID: PMC8394862.
- Doykov I, Hällqvist J, Gilmour KC, Grandjean L, Mills K, Heywood WE. ‘The long tail of Covid-19’ — The detection of a prolonged inflammatory response after a SARS-CoV-2 infection in asymptomatic and mildly affected patients. F1000Res. 2020 Nov 19;9:1349. doi: 10.12688/f1000research.27287.2. PMID: 33391730; PMCID: PMC7745182.
- Fogarty H, Karampini E, O’Donnell AS, Ward SE, O’Sullivan JM, O’Donnell JS; Irish COVID-19 Vasculopathy Study (iCVS) investigators. Persistent endotheliopathy in the pathogenesis of long COVID syndrome — Reply to comment from von Meijenfeldt et al. J Thromb Haemost. 2022 Jan;20(1):270-271. doi: 10.1111/jth.15578. Epub 2021 Nov 22. PMID: 34738307; PMCID: PMC8646468.
- Loktionova IL, Pokrovskiy MV, Ragulina VA, Titareva LV, Denisuk ТА, Stupakova EV,Sytnik МV, Saroyan KV, Losenok SА. The status of vascular endotheliumfunction in infectious diseases of various etiologies // Nauchnye vedomosti, Seriya Medicina. Farmaciya. 2012. No 4 (123);17/1: 20–31
- Kühnl A, Rien C, Spengler K, Kryeziu N, Sauerbrei A,Heller R, Henke A. Characterization of coxsackievirus B3replication in human umbilical vein endothelial cells // Med Microbiol Immunol. 2014;203(4):217–229. Doi: 10.1007/s00430-014-0333-6. PMID: 24615265.
- Han T, Lai Y, Jiang Y, Liu X, Li D. Influenza A virus infects pulmonary microvascular endothelial cells leading tomicrovascular leakage and release of pro-inflammatory cytokines // Peer J. 2021;(9):e11892. Doi: 10.7717/peerj.11892.PMID: 34414033; PMCID: PMC8344683.
- Han T, Lai Y, Jiang Y, Liu X, Li D. Influenza A virus infects pulmonary microvascular endothelial cells leading to microvascular leakage and release of pro-inflammatory cytokines // Peer J. 2021;(9):e11892. Doi: 10.7717/peerj.11892.PMID: 34414033; PMCID: PMC8344683.
- Herold S, Becker C, Ridge KM, Budinger GR. Influenza virus-induced lung injury: pathogenesis and implications for treatment // Eur Respir J. 2015;45(5):1463–1478. Doi:10.1183/09031936.00186214. PMID: 25792631.
- De Ciuceis C, Amiri F, Brassard P, Endemann DH, Touyz RM, Schiffrin EL. Reduced vascular remodeling, endothelial dysfunction, and oxidative stress in resistance arteries of angiotensin II-infused macrophage colony-stimulating factor-deficient mice: evidence for a role in inflammation in angiotensin-induced vascular injury. Arterioscler Thromb Vasc Biol. 2005 Oct;25(10):2106-13. doi: 10.1161/01.ATV.0000181743.28028.57. Epub 2005 Aug 11. PMID: 16100037.
- Ryoo, S., Berkowitz, D. E., & Lim, H. K. (2011). Endothelial arginase II and atherosclerosis. Korean Journal of Anesthesiology, 61(1), 3-11.
- В. Курята, Ю. С. Кушнір, Т. О. Віхрова. Медицина невідкладних станів. 2019. 3. 45-50. nbuv.gov.ua/UJRN/Medns_2019_3_9.
- Gambardella J, Khondkar W, Morelli MB, Wang X, Santulli G, Trimarco V. Arginine and Endothelial Function. Biomedicines. 2020; 8(8):277. doi.org/10.3390/biomedicines8080277
- Hasdai D, Gibbons RJ, Holmes DR Jr, Higano ST, Lerman A. Coronary endothelial dysfunction in humans is associated with myocardial perfusion defects. Circulation. 1997 Nov 18;96(10):3390-5. doi: 10.1161/01.cir.96.10.3390. PMID: 9396432
- Orsini E, Zito GB. Matching pathophysiology and evidence-based medicine for optimal management of ischemic heart disease. J Cardiovasc Med (Hagerstown). 2010;11(6):469-479
- В.О. Шумаков, Можливі шляхи ефективної енергетичної підтримки міокарда. Медична газета «Здоров’я України 21 сторіччя», № 5-6. 2022
- Luiking YC, Ten Have GA, Wolfe RR, Deutz NE. Аргінін de novo та утворення оксиду азоту в хворобливих станах. Am. J. Physiol. ендокринол. Метаб. 2012 рік; 303 :E1177–E1189. doi: 10.1152/ajpendo.00284.2012
- Palloshi A, Fragasso G, Piatti P, Monti LD, Setola E, Valsecchi G, Galluccio E, Chierchia SL, Margonato A. Effect of oral L-arginine on blood pressure and symptoms and endothelial function in patients with systemic hypertension, positive exercise tests, and normal coronary arteries. Am J Cardiol. 2004 Apr 1;93(7):933-5. doi: 10.1016/j.amjcard.2003.12.040. PMID: 15050504.
- Adams MR, McCredie R, Jessup W, Robinson J, Sullivan D, Celermajer DS. Oral L-arginine improves endothelium-dependent dilatation and reduces monocyte adhesion to endothelial cells in young men with coronary artery disease. Atherosclerosis. 1997 Mar 21;129(2):261-9. doi: 10.1016/s0021-9150(96)06044-3. PMID: 9105569.
- Maxwell AJ, Zapien MP, Pearce GL, MacCallum G, Stone PH. Randomized trial of a medical food for the dietary management of chronic, stable angina. J Am Coll Cardiol. 2002 Jan 2;39(1):37-45. doi: 10.1016/s0735-1097(01)01708-9. PMID: 11755284.
- Ceremuzynski L., Chamiec T., Herbaczynska-Cedro K. Effect of supplemental oral L-arginine on exercise capacity in patients with stable angina pectoris. Am. J. Cardiol. 1997;80:331–333. doi: 10.1016/S0002-9149(97)00354-8. [PubMed] [CrossRef] [Google Scholar] [Ref list]
- Tripathi P, Misra MK. Therapeutic role of L-arginine on free radical scavenging system in ischemic heart diseases. Indian J Biochem Biophys. 2009 Dec;46(6):498-502. PMID: 20361713.
- Yin, W. H., Chen, J. W., Tsai, C., Chiang, M. C., Young, M. S., & Lin, S. J. (2005). L-arginine improves endothelial function and reduces LDL oxidation in patients with stable coronary artery disease. Clinical Nutrition, 24(6), 988-997.
- Schneider, J.Y., Rothmann, S., Schröder, F. et al. Effects of chronic oral L-arginine administration on the L-arginine/NO pathway in patients with peripheral arterial occlusive disease or coronary artery disease: L-Arginine prevents renal loss of nitrite, the major NO reservoir. Amino Acids 47, 1961–1974 (2015). org/10.1007/s00726-015-2031-0
- Song X, Qu H, Yang Z, Rong J, Cai W, Zhou H. Efficacy and Safety of L-Carnitine Treatment for Chronic Heart Failure: A Meta-Analysis of Randomized Controlled Trials. Biomed Res Int. 2017;2017:6274854. doi: 10.1155/2017/6274854. Epub 2017 Apr 13. PMID: 28497060; PMCID: PMC5406747.
- В.О, Шумаков- Ефективність терапії пацієнтів із ішемічною хворобою серця з застосуванням фіксованої комбінації L-аргініну та L-карнітину з точки зору доказової медицини. Огляд міжнародних наукових джерел. Ukrainian Medical Journal.2021.143. 10.32471/umj.1680-3051.143.207515
- В.К. Тащук Медична газета «Здоров’я України 21 сторіччя», тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» 2020
- DiNicolantonio JJ, Lavie CJ, Fares H, Menezes AR, O’Keefe JH. L-carnitine in the secondary prevention of cardiovascular disease: systematic review and meta-analysis. Mayo Clin Proc. 2013 Jun;88(6):544-51. doi: 10.1016/j.mayocp.2013.02.007. Epub 2013 Apr 15. PMID: 23597877.
- Askarpour M, Hadi A, Miraghajani M, Symonds ME, Sheikhi A, Ghaedi E. Beneficial effects of l-carnitine supplementation for weight management in overweight and obese adults: An updated systematic review and dose-response meta-analysis of randomized controlled trials. Pharmacol Res. 2020 Jan;151:104554. doi: 10.1016/j.phrs.2019.104554. Epub 2019 Nov 17. PMID: 31743774.
- І.О. Мітюряєва — Корнійко Імуномодулюючі можливості l-карнітіну – іноваційне медикаментозне супроводження терапії інфекційногопроцесу. Міжнародний журнал педіатрії, акушерства та гінекології Липень/Вересень 2018 Том 12 №3
- Koc A, Ozkan T, Karabay AZ, Sunguroglu A, Aktan F. Effect of L-carnitine on the synthesis of nitric oxide in RAW 264·7 murine macrophage cell line. Cell Biochem Funct. 2011 Dec;29(8):679-85. doi: 10.1002/cbf.1807. Epub 2011 Oct 19. PMID: 22012571.
- SCORE2 risk prediction algorithms:new models to estimate 10-year risk of cardiovascular disease in Europe European Heart Journal (2021) 00, 1–16 CLINICAL RESEARCH doi:10.1093/eurheartj/ehab309