Болевой синдром в неврологии: эффективный старт терапии

Мышечно-скелетные боли различной локализации (боль в шее, конечностях, спине, суставах, а также разлитая боль) является одной из ведущих причин обращения пациентов к врачу первичного звена (Main C.J., Williams A.C., 2002). Боль в нижней части спины (БНЧС) является патологическим состоянием опорно-двигательного аппарата, оказывающего значительное неблагоприятное влияние на качество жизни. По определению, БНЧС представляет собой боль, окоченение или мышечное напряжение, локализованное между нижним краем нижних ребер и седалищными складками (Vlaeyen J. W.S. et al., 2018; Urits A. et al., 2019).
БНЧС распространен во всем мире и является одной из ведущих причин инвалидности (Safiri S. et al., 2021). Анализ данных Глобального бремени болезней (Global Burden of Disease), опубликованный в январе 2022 г., свидетельствует о том, что стандартизированная по возрасту распространенность БНЧС составляет 6972,5 случая на 100 000 населения. Интересно, что самые высокие показатели распространенности БНЧС наблюдаются в индустриализованных странах с высоким уровнем достатка (США, Дания, Швейцария) (Chen S. et al., 2022). По данным популяционного исследования J. K. Freburger и соавт. (2009), в мире наблюдается как рост распространенности БНЧС, так и увеличение расходов на ее лечение. В тот или иной период своей жизни БНЧС страдает ≈⅔ взрослого населения планеты (Deyo R. A., Weinstein J. N., 2001).
Причинами БНЧС могут быть разноплановые факторы, однако ≈97% случаев имеют механическую этиологию, т. е. являются следствием разнообразных микротравм поясничного отдела позвоночника и ассоциированных с возрастом дегенеративных процессов в межпозвонковых дисках, реже – грыж дисков и остеопоротических компрессионных переломов (Deyo R. A., Weinstein J. N., 2001). Немеханические причины (новообразование, инфекционные и воспалительные артриты, заболевания висцеральных органов) вызывают БНЧС гораздо реже (Zippel H., Wagenitz A., 2007). В целом пациентов с БНЧС можно разделить на лиц с неспецифической болью (≈85%), лиц со специфической болью или тяжелой спинальной патологией и лиц с радикулярной болью. В связи с этим диагностические мероприятия при БНЧС в основном направлены на выявление «красных флагов» – признаков опухоли, перелома или инфекции, а также на исключение болезней, вызывающих специфическую боль (Koes B. W. et al., 2001).
Нередко БНЧС хронизируется и беспокоит пациентов в течение длительного времени (Dunn K. M. et al., 2013; Meucci R. D. et al., 2015). Персистирующая БНЧС ассоциируется с рядом дополнительных вторичных проблем и болезней, в т. ч. с расстройствами сна, тревожностью, депрессией, мышечно-скелетными болями другой локализации (Duffield S. J. et al., 2017; Gore M. et al., 2012; Scarpsno E. S. et al., 2020; Hartvigsen J. et al., 2013).
Основной группой средств, применяемых в лечении БНЧС, являются нестероидные противовоспалительные препараты (НПВП), причем, согласно рекомендациям Североамериканского общества позвоночника (North American Spine Society, 2020), именно неселективные НПВП, такие как декскетопрофен.
Декскетопрофен представляет собой НПВП, который относится к подгруппе производных арилпропионовой кислоты и является S-изомером, изолированным из рацемического кетопрофена (Brzezinski K., Wordliczek J., 2013). Исследования продемонстрировали, что S-изомер является в несколько раз более мощным ингибитором циклооксигеназы 1 и 2 типа, чем рацемический кетопрофен (Carabaza A. et al., 1997; Cabre F. et al., 1998). Кроме того, декскетопрофену присуща в 5 раз более низкая ульцерогенная активность, чем рацемической смеси (GichI. et al., 1996). Создание декскетопрофена как хирально чистого S-изомера кетопрофена позволило достичь таких преимуществ, как потребность в низких дозах препарата, снижение метаболической нагрузки, избегание лекарственных взаимодействий и резкое уменьшение вероятности побочных реакций (Hardikar M.S., 2008). Это подтверждается данными J. R. Laporte и соавт. (2004), проанализировавших >4000 случаев гастроинтестинальных кровотечений и выяснивших, что наибольшим относительным риском этого осложнения характеризуется кеторолак (24,7; 95% доверительный интервал (ДИ) 8,0-77,0). Для декскетопрофена этот показатель составляет 4,9 (95% ДИ 1,7-13,9), для мелоксикама – 5,7 (95% ДИ 2,2-15,0), а для рофекоксиба – 7,2 (95% ДИ 2,3-23,0).
В рандомизированное двойное слепое многоцентровое исследование H. Zippel и A. Wagenitz (2007) было включено 370 амбулаторных пациентов с острой БНЧС, которых рандомизировали в группы внутримышечного применения декскетопрофена (50 мг 2 г/сут) и диклофенака (75 мг 2 р/сут) в течение 2 дней. Оказалось, что снижение интенсивности боли по визуальной аналоговой шкале (ВАШ) через 6 ч после введения первой дозы декскетопрофена составило 117,3 мм/ч, а после введения диклофенака – 114,7 мм/ч. В обеих группах наблюдалась одинаковая потребность в препаратах спасения, а также необходимость улучшения функциональных возможностей; частота побочных эффектов также была примерно сопоставимой. Авторы пришли к выводу, что декскетопрофен обеспечивает клинически значимый аналгетический эффект при БНЧС и имеет хорошую переносимость как при однократном, так и при повторном применении.
В соответствии с приказом у МЗ Украины от 29.12.2012 № 751 универсальным источником клинических руководств является Кокрановская база данных систематических обзоров. Выводы Кокрановских метаанализов рекомендуется использовать для внедрения в практику эффективных методов лечения. Проспективное рандомизированное двойное слепое исследование Э. Demirozogul и соавт. (2019), которое входит в Кокрановский центральный реестр контролируемых исследований, включало 200 пациентов с разными видами острой нетравматической мышечной боли. Пациенты были рандомизированы в группы внутривенного применения декскетопрофена (50 мг) и парацетамола (1000 мг). Оказалось, что декскетопрофен был достоверно эффективнее по ВАШ и числовой шкале оценки боли во всех проанализированных локализациях болевых ощущений (р=0,001).
Метаанализ R. A. Moore и J. Barden (2008) обнаружил, что в лечении острой и хронической боли все возможные дозы декскетопрофена имеют преимущество над плацебо и (по меньшей мере) сопоставимую эффективность с кетопрофеном в дозе 100 мг, трамадолом в дозе 100 мг, диклофенаком в дозе 75 мг 2 г/день. Декскетопрофен имеет отличные показатели эффективности и безопасности не только при БНЧС, но и при ряде других нозологий. Так, инъекционное применение декскетопрофена обеспечивало отсутствие / низкую интенсивность боли в 93,3% случаев ударноволновой литотрипсии при мочекаменной болезни, а инъекционное применение диклофенака – лишь у 85% (Tokgoz H. et al., 2010).
Декскетопрофен эффективен также при мигрени. Метаанализ B. Yang и соавт. (2019), включавший 5 рандомизированных контролируемых исследований с участием 749 пациентов, обнаружил, что по сравнению с контрольной группой применение декскетопрофена ассоциировалось с достоверно большей вероятностью отсутствия боли через 2 ч (отношение рисков (ОР) 1,90; 94% ДИ 1-2,53; р<0,0001) и 48 ч (ОР 1,63; 95% ДИ 1,07-2,49; р=0,02) после введения, а также оценкой эффекта лечения как хорошего/отличного (ОР 1,48; 95% ДИ 1,24-1,78). Применение декскетопрофена сопровождалось меньшей потребностью в препаратах спасения (ВР 0,64; 95% ДИ 0,43-0,94; р=0,02). Что немаловажно, все преимущества декскетопрофена наблюдались на фоне отсутствия достоверного роста частоты развития побочных эффектов. В целом декскетопрофен относится к НПВП с умеренным риском кровотечений из верхних отделов желудочно-кишечного тракта, в отличие от кеторолака, пироксикама, индометацина, кетопрофена, напроксена и аспирина, которым присущ высокий риск (Aranguren I. et al., 2016).
Что касается кардиоваскулярной безопасности декскетопрофена, исследование, включавшее данные около 10 млн пациентов из европейских стран, показало, что применение этого препарата, в отличие от ряда неселективных НПВП и коксибов, не увеличивает частоты госпитализаций по поводу сердечной недостаточности (рис.) (Arfe А. et al., 2016).
Весомой проблемой комплексного лечения больных является межлекарственное взаимодействие, особенно в случаях, когда побочные эффекты назначенных препаратов могут усиливать друг друга. Установлено, что декскетопрофен можно безопасно применять в сочетании с низкомолекулярными гепаринами (НМГ). В многоцентровом рандомизированном двойном слепом исследовании H. Zippel и A. Wagenitz (2007) приняли участие 252 пациента с болью умеренной и высокой интенсивности после ортопедических хирургических вмешательств, 94,4% из них получали НМГ. Было продемонстрировано, что внутривенное применение декскетопрофена в сочетании с НМГ не сопровождалось ростом количества геморрагических событий. В другом исследовании декскетопрофен назначался с НМГ в профилактических дозах пациентам с травмами и лицам после ортопедических хирургических вмешательств. Авторы обнаружили, что между НМГ и декскетопрофеном отсутствуют какие-либо взаимодействия, которые могут оказать существенное влияние на параметры свертывания крови. Хотя было зафиксировано определенное увеличение количества небольших кровотечений, количество крупных и клинически значимых кровотечений в послеоперационном периоде осталось прежним. Комбинация НМГ и декскетопрофена не увеличивала вероятности кровотечения из послеоперационной раны и кровопотерь из-за дренажей, а также не повышала потребность в переливаниях крови (Кучин Ю., 2014).
Дополнительным преимуществом декскетопрофена является то, что хемореактомный анализ этого препарата выявил потенциальные вазодилатирующие, антиагрегантные, противодиабетические и противоопухолевые свойства этой молекулы (Торшин И. Ю. и соавт., 2018).
Препарат Кейдекс Инъект® является инъекционной формой декскетопрофена для внутримышечного и внутривенного введения. Выявленные преимущества над другими НПВП, в частности диклофенаком, позволяют считать Кейдекс Инъект® новым золотым стандартом аналгезии. Кейдекс Инъект® содержит декскетопрофен в форме водорастворимой соли декскетопрофена трометамола, что обеспечивает быстрое достижение максимальной концентрации действующего вещества (через 20 (10-45) минут), а следовательно, быстрое наступление обезболивающего эффекта. Важно также то, что декскетопрофен быстро элиминируется из организма и не накапливается в тканях даже при применении 3 г/день (Barbanoj M. J. et al., 2001; Walczak J. S., 2011). Показания к применению препарата Кейдекс Инъект® – симптоматическое лечение острой боли средней и высокой интенсивности в случаях, когда пероральное использование препарата нецелесообразно, например при послеоперационных болях, почечных коликах, боли в пояснице (БНЧС). На фоне кратковременного применения препарата Кейдекс Инъект® в соответствии с инструкцией для медицинского использования (не более 2 суток) профиль побочных эффектов этого препарата соответствует профилю плацебо (Walczak J. S., 2011).
Таким образом, Кейдекс Инъект® является оптимальным стартовым препаратом для обезболивания, поскольку имеет такие преимущества, как эффективность, отличный профиль гастроинтестинальной и кардиоваскулярной безопасности, высокая скорость наступления эффекта.
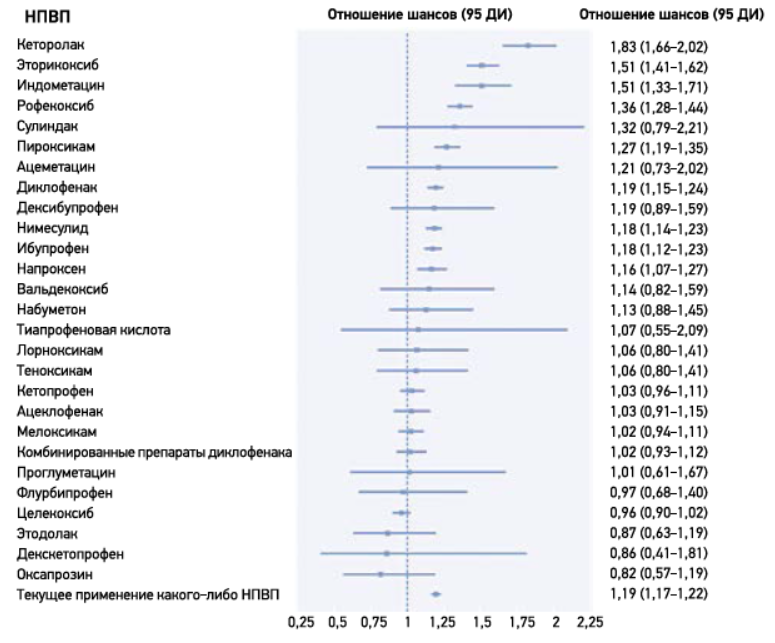
Рис. Обобщенные ассоциации между текущим употреблением отдельных НПВП и риском госпитализации по поводу сердечной недостаточности
Ключевые слова: Дорсопатия, БНЧС, декскетопрофен
Авторы: Гриб В.А., д.м.н., профессор, заведующая кафедрой неврологии и нейрохирургии Ивано-Франковского национального медицинского университета.