Дексмедетомiдин, Пропофол та їх комбiнацiядля седацiїї пацiєнтiв зi станом вiдмiниалкоголю у вiддiленнi iнтенсивної терапiї: проспективне контрольоване дослiдження

Метa – визначити ефективнiсть та безпечнiсть пропофолу, дексмедетомiдину та їх комбiнацiю для седацiї пацiєнтiв з тяжким станом вiдмiни алкоголю у вiддiленнi iнтенсивної терапiї.
Матерiали та методи. У дослiдження залучено 210 пацiєнтiв, яких розподiлили на чотири групи – група дексмедетомiдiну, пропофолу, дексмедетомiдiну та пропофолу i контрольна. Тривалiсть госпiталiзацiї у вiддiлення iнтенсивної терапiї становила вiдповiдно 51 год [46–75], 68 год [48–98], 68 год [48– 78 та 92 год [70–102]. Групи достовiрно не вiдрiзнялися за частотою ускладненого перебiгу стану вiдмiни алкоголю та летальнiстю.
Результати. Споживання дiазепаму та кiлькiсть пацiєнтiв, якi потребували призначення галоперидолу, були достовiрно меншими, а якiсть седацiї та комунiкацiї з пацiєнтами – значно кращими в групах дослідженя порівняно з контрольною групою.
Висновок. Дексмедетомідин, пропофол та їх комбінація є ефективним та безпечними для седації пацієнтів зі станом відміни алкоголю і відділеннях інтенсивної терапії.
Ключовi слова: стан вiдмiни алкоголю, седацiя, пропофол, дексмедетомiдин, дiазепам.
Проблема зловживання алкоголем є актуальною в свiтi та в Українi зокрема. Близько 20% госпiталiзованих пацiєнтiв мають алкогольну залежнiсть, з них у 18%протягом госпiталiзацiї виникає стан вiдмiни алкоголю [1]. Розвиток стану вiдмiни алкоголю погiршує результати лiкування, збiльшуючи тривалiсть госпiталiзацiї, ризик iнфекцiйних ускладнень, потребу у ре спiраторнiй пiдтримцi, пiдвищує летальнiсть та вартiсть лiкування [2].
Бензодiазепiни (БЗД) – ефективнi та рекомендованi препарати для контролю симптомiв стану вiдмiни [3]. Проте у пацiєнтiв з тяжким станом вiдмiни монотерапiя БЗД часто є недостатньою, а великi дози БЗД асоцiюються з ризиком пригнiчення дихання, iнтубацiї трахеї, iнфекцiйних ускладнень та прогресування делiрiю [3, 4]. Є данi про застосування альтернативних препаратiв для лiкування стану вiдмiни алкоголю – барбiтуратiв, нейролептикiв, протисудомних, β-блокаторiв, мiорелаксантiв, етанолу, проте жоден з них не має доведеної ефективностi та безпечностi та не є рекомендованим для пацiєнтiв зi станом вiдмiни [1, 4].
Пропофол та дексмедетомідин – перспективнi альтернативнi препарати для седацiї пацiєнтiв зi станом вiдмiни алкоголю. Пропофол, як i БЗД, є агонiстом рецепторiв α-амiномасляної кислоти (ГАМК), проте на вiдмiну вiд БЗД знижує ризик пригнiчення дихання, тривалiсть штучної вентиляцiї легень. (ШВЛ) та має кращу протисудомну активнiсть [5]. До того ж пропофол є добре керованим препаратом з коротким перiодом напiввиведення [5]. Дексмедетомiдин, селективний агонiст α-адренорецепторiв, окрiм седативних та аналгетичних властивостей, знижує симпатичну активнiсть, що нерiдко є проблемою у пацiєнтiв зi станом вiдмiни алкоголю та потребує додаткового призначення β-блокаторiв [6]. Iншими перевагами дексмедетомiдину є короткий перiод напiввиведення, забезпечення так званої кооперативної седацiї, вiдсутнiсть впливу на дихальну функцiю [6]. Деякi автори повiдомляють про успiшне застосування пропофолу [7, 8] та дексмедетомiдину [9, 10] у пацiєнтiв зi станом вiдмiни алкоголю.
Мета дослiдження – визначити ефективнiсть та безпечнiсть пропофолу, дексмедетомiдину та їх комбiнацiї для седацiї пацiєнтiв з тяжким станом вiдмiни алкоголю у вiддiленнi iнтенсивної терапiї.
МАТЕРIАЛИ ТА МЕТОДИ
Проспективне контрольоване дослiдження проведено на клiнiчнiй базi кафедри анестезiологiї та iнтенсивної терапiї Нацiонального медичного унiверситету iменi О.О.Богомольця – ТОВ “Борис” у перiод iз сiчня 2013 р. до червня 2015 р. Протокол дослiдження було затверджено комiсiєю з етики Нацiонального медичного унiверситету iменi О.О. Богомольця.
У дослiдження залучено дорослих 210 пацiєнтiв зi станом вiдмiни алкоголю, якi були госпiталiзованi у вiддiлення iнтенсивної терапiї (ВIТ) та мали показання до медикаментозної седацiї для контролю симптомiв стану вiдмiни. Дiагноз стану вiдмiни алкоголю встановлювали за критерiями Diagnostic and statistical manual of mental disorders-IV [11].
Критерiями виключення з дослiдження були: вiк молодше 18 рокiв та понад 70 рокiв; неможливiсть отримати iнформовану згоду пацiєнта або його законного представника; стан вiдмiни iнших психоактивних речовин або вiдомостi про їх вживання; проведення загальної анестезiї протягом останнiх 24 год або необхiднiсть її проведення; вагiтнiсть або лактацiя; тяжка супутня патологiя (черепно-мозкова травма, гостре порушення мозкового кровообiгу, хронiчна серцева недостатнiсть (New York Heart Association Functional Classification (NYHA), клас III-IV), дихальна недостатнiсть, ниркова недостатнiсть зi зниженням клiренсу креатинiну менше нiж 30 мл/(хв · 1,73м2), печiнкова недостатнiсть класу С за класифiкацiєю Чайлда-Пью), епiлепсiя, психiчнi захворювання, наркоманiя; iндивiдуальна чутливiсть до препаратiв для седацiї.
Пiсля первинної оцiнки пацiєнтiв розполiлили на чотири групи: групу дексмедетомiдину (гр. Д, n=54), групу пропофолу (гр. П, n=50), групу дексмедетомiдину та пропофолу (гр. Д+П, n=50) i контрольну групу (гр. К, n=56). Цiльовим рiвнем седацiї в усiх групах вважали значення вiд –2 до 0. Пацiєнтам гр. Д розпочинали внутрiшньовенну iнфузiю розчину дексмедетомiдину у дозi 0,2–1,7 мкг/кг маси тiла на годину i титрували до досягнення цiльового рiвня седацiї. Пацiєнтам гр. П проводили внутрiшньовенну iнфузiю розчину пропофолу у дозi 0,5–5,0 мг/ маси тiла на годину i титрували для досягнення цiльового рiвня седацiї. Пацiєнтам гр. Д+П розпочинали одночасну iнфузiю дексмедетомiдину та пропофолу у дозi 0,2–1,7 та 0,5–5,0 мг/кг маси тiла на годину вiдповiдно. БЗД призначали пацiєнтам усiх груп за симптомзалежним протоколом: внутрiшньовенний болюс дiазепаму 10 мг кожнi 30 хв при CIWA-Ar15 балiв. Антипсихотики (галоперидол у дозi 5 мг внутрiшньовенно) призначали за потребою при тяжкому збудженнi та галюцинацiях у пацiєнтiв з нормальним QTs-часом. Iншi седативнi/опiоїднi аналгетики не використовували пiд час дослiдження.
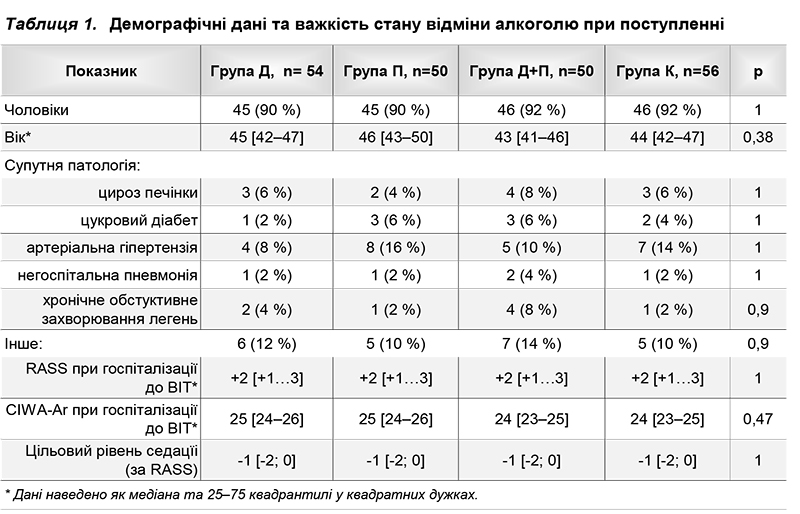
Групи статистично не вiдрiзнялися за вiком, спiввiдношенням статей, супутньою патологiєю, тяжкiстю стану вiдмiни алкоголю та початковим рiвнем збудження. Данi щодо рiвня ажитацiї i тяжкостi стану вiдмiни алкоголю при госпiталiзацiї наведено в табл. 1.
Первинними результатами лiкування були тривалiсть госпiталiзацiї у ВIТ та ускладнений перебiг стану вiдмiни алкоголю (судоми, делiрiй тременс, енцефалопатiя Вернiке, пневмонiя, панкреатит та летальнiсть). Вторинними результатами лiкування були:
- споживання БЗД протягом перших 24 год пiсля початку дослiдження та кумулятивна доза за час госпiталiзацiї у ВIТ;
- кiлькiсть пацiєнтiв, якi потребували призначення галоперидолу;
- якiсть седацiї: тривалiсть цiльового рiвня седацiї (вiдношення тривалостi цiльового рiвня седацiї до загального часу седацiї), тривалiсть надмiрної/недостатньої седацiї (вiдношення тривалостi надмiрного седостатнього рiвня седацiї до загального часу седацiї), кiлькiсть вимушених зупинок седацiї;
- якiсть комунiкацiї з пацiєнтом (за 10-бальною шкалою, де 0 – вiдсутнiсть продуктивного контакту, 10 – задовiльний контакт з пацiєнтом);
- показники когнiтивних функцiй та частота розвитку депресивних i тривожних розладiв на момент виписки з лiкарнi (вiдповiдно за шкалами Minimal Mental Exam (MMSE), Hospital Anxiety Depression Scale (HADS)).
Критерiями оцiнки безпечностi були частота побiчних ефектiв та ускладнень у групах.
Усiм пацiєнтам проводили цiлодобовий монiторинг вiтальних функцiй, ЕКГ. Монiторинг ефективностi спонтанного дихання передбачав постiйну пульсоксиметрiю та аналiз газiв кровi кожнi 12 год або додатково за призначенням лiкаря (PaO2, PaCO2, SaO2). Рiвень седацiї оцiнювали кожнi 2 год за шкалою RASS, тяжкiсть стану вiдмiни –кожнi 4–6 год та пiсля болюсу дiазепаму за шкалою CIWA-Ar.
Статистичний аналiз проводили з використанням програмами Statistica 8.0 та R. Категорiальнi данi представлено як пропорцiї, неперервнi – як медiану та 25 i 75 квадрантилi. Для визначення нормальностi розподiлу даних у виборцi застосовували тест-X2. Бiльшiсть результатiв у дослiдженнi є непараметричними. Для оцiнки достовiрностi використовували тест Манна-Уїтнi, Крушкала-Уолiса та подвiйний критерiй Фiшера. Вiрогiднiсть помилки (р) вважали незначущою при р<0,05.
РЕЗУЛЬТАТИ
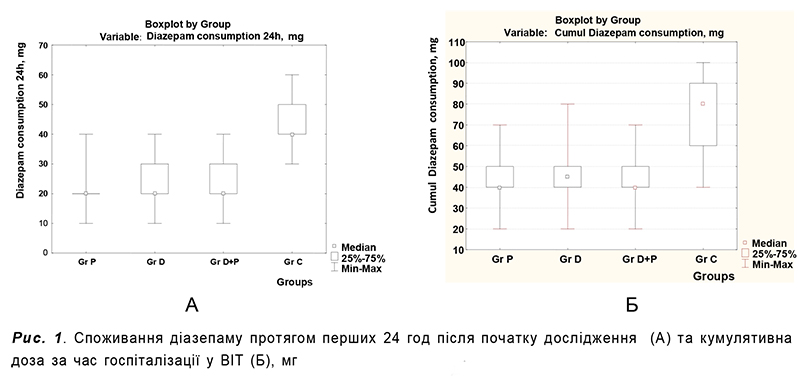
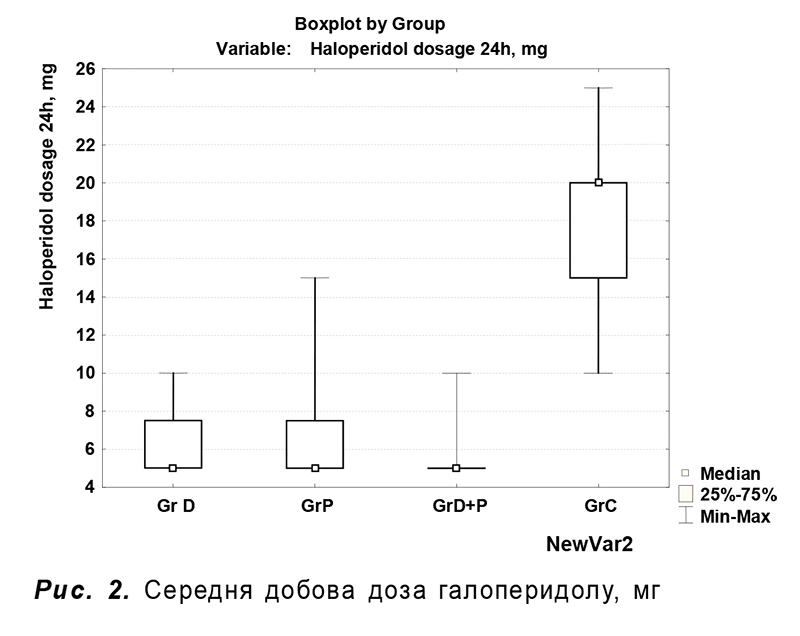
Тривалiсть госпiталiзацiї у ВIТ становила 51 год [46–75]* у групi Д, 68 год [48–98] у групi П, 68 год [48–78] у групi Д+П та 92 год [70–102] у групi К. Групи дослiдження достовiрно вiдрiзнялися за цим показником вiд контрольної групи (р=0,001), проте не мали достовiрних вiдмiнностей мiж собою (р=0,15). Групи також достовiрно не вiдрiзнялися за частотою ускладненого перебiгу стану вiдмiни алкоголю та летальнiстю (табл.). Чотири пацiєнти з групи Д та 6 пацiєнтiв з групи К були виключенi з дослiдження через недостатнiй контроль симптомiв стану вiдмiни (р=0,74) з використанням дослiджуваних препаратiв (дексмедетомiдин, дiазепам, галоперидол). У всiх 10 пацiєнтiв дiагностовано делiрiй тременс Вториннi результати лiкування наведено у табл. 2. Тривалiсть седацiї була найменшою в групi Д – 48 год [41–60], дещо бiльшою в групах П та Д+П – 62 [45–91] та 55 [39–62] год вiдповiдно. Групи дослiдження достовiрно (р<0,001) вiдрiзнялися вiд контрольної групи за споживанням дiазепаму та кiлькiстю пацiєнтiв, якi потребували призначення нейролептикiв (рис. 1 та 2).
Якiсть седацiї була достовiрно кращою в групах дослiдження порiвняно з контрольною групою. У групi Д при високому показнику тривалостi цiльової седацiї (85%), решту часу рiвень седацiї був недостатнiм (15%). У групi П тривалiсть цiльової седацiї була нижчою (76%) за рахунок збiльшення часу надмiрної седацiї (8%). Група Д+П мала промiжнi результати. У групi К тривалiсть цiльового рiвня седацiї була достовiрно нижчою (60%) порiвняно з iншими групами за рахунок часу як недостатньої (24%), так i надмiрної седацiї (17%).
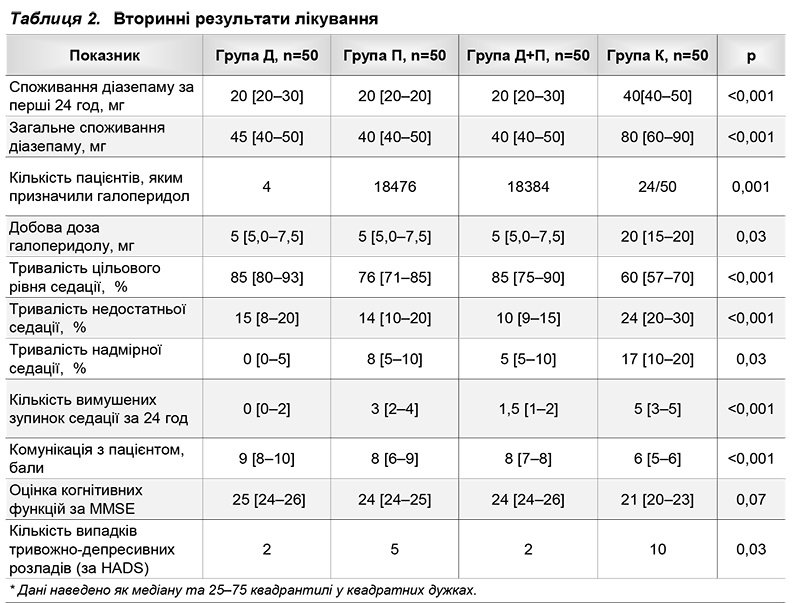
Комунiкацiя з пацiєнтом була найкращою в групi Д (9 балiв), найгiршою – в групi К (6 балiв; р<0,001).
Показники когнiтивних функцiй були достовiрно вищими у дослiджуваних групах порiвняно з групою К, а найвищими – в групi Д. Частота депресивних i тривожних розлаiв достовiрно не вiдрiзнялася у групах з тенденцiєю до пiдвищення у групi К (р=0,1).
ОБГОВОРЕННЯ
Одним з основних напрямiв iнтенсивної терапiї пацiєнтiв з тяжким станом вiдмiни алкоголю є медикаментозна седацiя. БДЗ – найпоширенiшi препарати для седацiї таких пацiєнтiв, проте вони мають низку недолiкiв i часто є недостатньо ефективними в якостi монотерапiї [1]. В Українi не зареєстрованi БЗД короткої (наприклад, мiдазолам) i тривалої дiї (наприклад, лоразепам). З урахуванням даних лiтератури та власного досвiду iнтенсивiсти нерiдко використовують iншi препарати для седацiї таких пацiєнтiв – пропофол та дексмедетомiдин, проте їх ефективнiсть та безпечнiсть недослiдженi [1].
Потенцiйнi переваги дексмедетомiдину пов’язанi iз забезпеченням “кооперативної” седацiї та симпатиколiзису без пригнiчення дихання. Препарат асоцiюється з кращим контролем симптомiв вiдмiни та рiвня седацiї, зменшенням потреби у респiраторнiй пiдтримцi та частоти ускладнень, пригнiченням симпатичної гiперактивностi [9, 10].
Пропофол, як i БЗД, взаємодiє з ГАМК-рецепторами. Вiн також iнгiбує глутаматнi рецептори [7], якi вiдiграють центральну роль у розвитку стану вiдмiни [8]. Багато авторiв повiдомляють про успiшне застосування пропофолу для седацiї пацiєнтiв з тяжким станом вiдмiни алкоголю [7], а огляди стратегiй лiкування стану вiдмiни в рiзних країнах свiдчать про його часте застосування у практицi ВIТ [8]. Останнiм часом з’явилися повiдомлення про одночасне застосування дексмедетомiдину та пропофолу, що може полiпшити якiсть седацiї, зменшити частоту побiчних ефектiв та споживання обох анестетикiв [12]. За результатами нашого дослiдження, дексмедетомiдин, пропофол та їх комбiнацiя були ефективними для седацiї пацiєнтiв зi станом вiдмiни у ВIТ. Порiвняно з монотерапiєю БДЗ додавання дексмедетомiдiну та/або пропофолу для седацiї таких пацiєнтiв скорочувало тривалiсть госпiталiзацiї у ВIТ, зменшувало споживання дiазепаму та потребу у призначеннi нейролептикiв. Якiсть седацiї та комунiкацiї з пацiєнтом була достовiрно кращою в групах дослiдження порiвняно з контрольною групою, а найкращою – у групi дексмедетомiдину.
Застосування дексмедетомiдину та/або пропофолу не впливало на ризик ускладненого перебiгу стану вiдмiни алкоголю, проте седацiя дексмедетомiдином зменшувала ризик iнтубацiї трахеї та ШВЛ (табл. 3). Гiпотензiя та брадикардiя виникали достовiрно частiше у групах дексмедетомiдину та його комбiнацiї з пропофолом. У бiльшостi випадкiв було достатньо корекцiї дози седативних препаратiв без застосування додаткових медикаментiв. Побiчнi ефекти з боку дихання – десатурацiя та брадипное –найчастiше виникали у групi пропофолу, що свiдчить про необхiднiсть проведення монiторингу дихання при застосуваннi пропофолу у пацiєнтiв зi станом вiдмiни алкоголю.
Дексмедетомiдин достовiрно знижував частоту делiрiю тременс, однiєї з найтяжчих манiфестацiй стану вiдмiни алкоголю, яка супроводжується високою частотою ускладнень та летальнiстю вiд 1 до 15% [1]. Проте у пацiєнтiв, в яких дiагностовано делiрiй тременс, комбiнацiї дексмедетомiдину з дiазепамом та галоперидолом виявилося недостатньо для досягнення цiльового рiвня седацiї та контролю симптомiв. Цi пацiєнти були виключенi з дослiдження. Їм призначили додатковi седативнi препарати (пропофол). Можливо, це пов’язано з тим, що дексмедетомiдин є препаратом для легкої та помiрної седацiї, тому його ефекту було недостатньо для пацiєнтiв з тяжким збудженням.
Опублiковане лише одне обсервацiйне дослiдження, в якому повiдомлялося про позитивний досвiд застосування дексмедетомiдину у пацiєнтiв з делiрiєм ременс [7]. Це дослiдження має низку недолiкiв – вiдсутнiсть контрольної групи та визначення делiрiю за шкалою CAMICU, яка не є специфiчною для делiрiю тременс. Необхiдно провести контрольованi дослiдження, щоб зробити остаточнi висновки щодо ефективностi дексмедетомiдину у пацiєнтiв з ДТ За оцiнкою когнiтивних функцiй на момент виписки зi стацiонару пацiєнти групи дексмедетомiдину мали найкращi показники, достовiрно кращi за пацiєнтiв контрольної групи (див. табл. 3). Тривожно-депресивнi розлади найчастiше виникали у пацiєнтiв контрольної групи та найрiдше – у пацiєнтiв групи дексмедетомiдину (р=0,1)/ Таким чином, дексмедетомiдин є ефективним та безпечним препаратом для седацiї пацiєнтiв зi станом вiдмiни алкоголю, забезпечує контрольовану седацiю та хорошу комунiкацiю з пацiєнтом, знижує ризик розвитку делiрiю тременс, не пригнiчує дихання та має мiнiмальний вплив на когнiтивнi функцiї. Дексмедетомiдин може виявитися недостатньо ефективним у пацiєнтiв з делiрiєм тременс, якi потребують глибокої седацiї. Пропофол є ефективним для седацiї пацiєнтiв зi станом вiдмiни алкоголю, зокрема у пацiєнтiв з делiрiєм тременс, забезпечує добре керовану седацiю та комунiкацiю з пацiєнтом, достовiрно знижує потребу у БЗД та нейролептиках. Препарат може спричинити надмiрну седацiю та пригнiчення дихання, тому обов’язково проводять монiторинг спонтанного дихання. Комбiнацiя пропофолу та дексмедетомiдину також була достовiрно ефективнiшою порiвнян з контрольною групою для седацiї пацiєнтiв зi станом вiдмiни алкоголю, включаючи пацiєнтiв з делiрiєм тременс. Ця комбiнацiя дає змогу знизити споживання обох седативних препаратiв та зменшити ризик респiраторних ускладнень i надмiрної седацiї.
Автори: Бєлка К.Ю., Глумчер Ф.С., Кучин Ю.Л., Мухоморов А.Є., Перебийнiс М.В. (Нацiональний медичний унiверситет iменi О.О.Богомольця, Київ).
Література:
- Sarff M, Gold JA. (2010) Alcohol withdrawal syndromes in the intensive care unit. Crit Care Med;38:494–501.
- Awissi DK, Lebrun G, Fagnan M, Skrobik Y. (2013) Alcohol, nicotine, and iatrogenic withdrawals in the ICU. Crit Care Me; 41:57–68.
- Carlson RW, Kumar NK, Wong-Mckinstry E et al. (2012) Alcohol withdrawal syndrome. Crit Care Clin;28:549–595
- Barr J, Fraser GL, Puntillo K et al. (2013) Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med; 41:263-306.
- Vanlersberghe C, Camu F. (2008) PropofolHandb Exp Pharmacol;182:227–52.
- Dexmedetomidine (Precedex®) Package Insert. (2010) Hospira, Inc.
- Lizotte RJ, Kappes JA, Bartel BJ et al. (2014) Evaluating the effects of dexmedetomidine compared to propofol as adjunctive therapy in patients with alcohol withdrawal. ClinPharmacol.;1(6):71–7.
- Lorentzen K, Lauritsen A?, Bendtsen AO. (2014) Use of propofol infusion in alcohol withdrawal-induced refractory delirium tremens.Ann Pharmacother.;8(4):56–61.
- DeMuro JP, Botros DG, Wirkowski E, Hanna AF (2012) Use of dexmedetomidine for the treatment of alcohol withdrawal syndrome in critically ill patients: a retrospective case series. J Anesth;26:601–605
- Rayner SG, Weinert CR, Peng H et al. (2012) Dexmedetomidine as adjunct treatment for severe alcohol withdrawal in the ICU. Ann Intensive Care;2:12.
- Moss HB, Chen CM, Yi HY (2008) DSM-IV criteria endorsement patterns in alcohol dependence: relationship to severity. Alcohol ClinExp Res;32(2):306313.
- Ravipati P, Reddy PN, Kumar C et al. (2014) Dexmedetomidine decreases the requirement of ketamine and propofol during burns debridement and dressings. Indian J Anaesth.;58(2):138-42.