Роль піперациліну/тазобактаму у лікуванні ускладнених інтраабдомінальних інфекцій (УАІ) в лікарнях України: аналіз серії 40 клінічних випадків
Вступ. Антибіотикотерапія є одним із ключових компонентів лікування ускладнених абдомінальних інфекцій. За рекомендаціями ВООЗ піперацилін / тазобактам є антибіотиком першої лінії для лікування ускладнених інтраабдомінальних інфекцій. Проте в Україні цей препарат відносно рідко стає першим вибором для лікування УАІ.
Метою дослідження було провести ретроспективний аналіз результатів лікування серії клінічних випадків УАІ з використанням піперациліну / тазобактаму (Рефексу) в лікарнях України.
Методи: дослідження було проведено у період з 1 грудня 2022 по 30 червня 2023 за підтримки компанії «ЮРІЯ-ФАРМ».
Центрами дослідження були 4 заклади охорони здоров’я: КНП «КМКЛШМД», ЛШМД м. Вінниця, КНП ООКЛ ООР, КНП «КМКЛ№ 4». Після включення у дослідження пацієнтам призначали емпіричну терапію піперациліном/тазобактамом (Рефекс) та вносили дані пацієнта у бланк. Фіксувались результати терапії препаратом до початку терапії (0 день), на 3-й день після початку терапії та на 6-й день від початку терапії.
Результати: у дослідження було включено 40 пацієнтів. Серед збудників, що були виділені під час бактеріологічного дослідження виділень з ран пацієнтів, до групи «ESKAPE» відносились 24 випадки (60 %) збудників: E. Coli 9 випадків (22,5 %),S.Aureus 1 випадок (2,5 %), St. Haemolyticus склав 3 випадки (7,5 %), Kl. Pneumonia 4 випадки (10 %), Acinetobacter spp. 1 випадок (2,5 %), Ps. Aerоginosa 3 випадки (7,5 %), Enterobacter 1 випадок (2,5 %), Enterbacter cloaceae склав 2 випадки (5 %). Інші збудники склали 16 випадків.
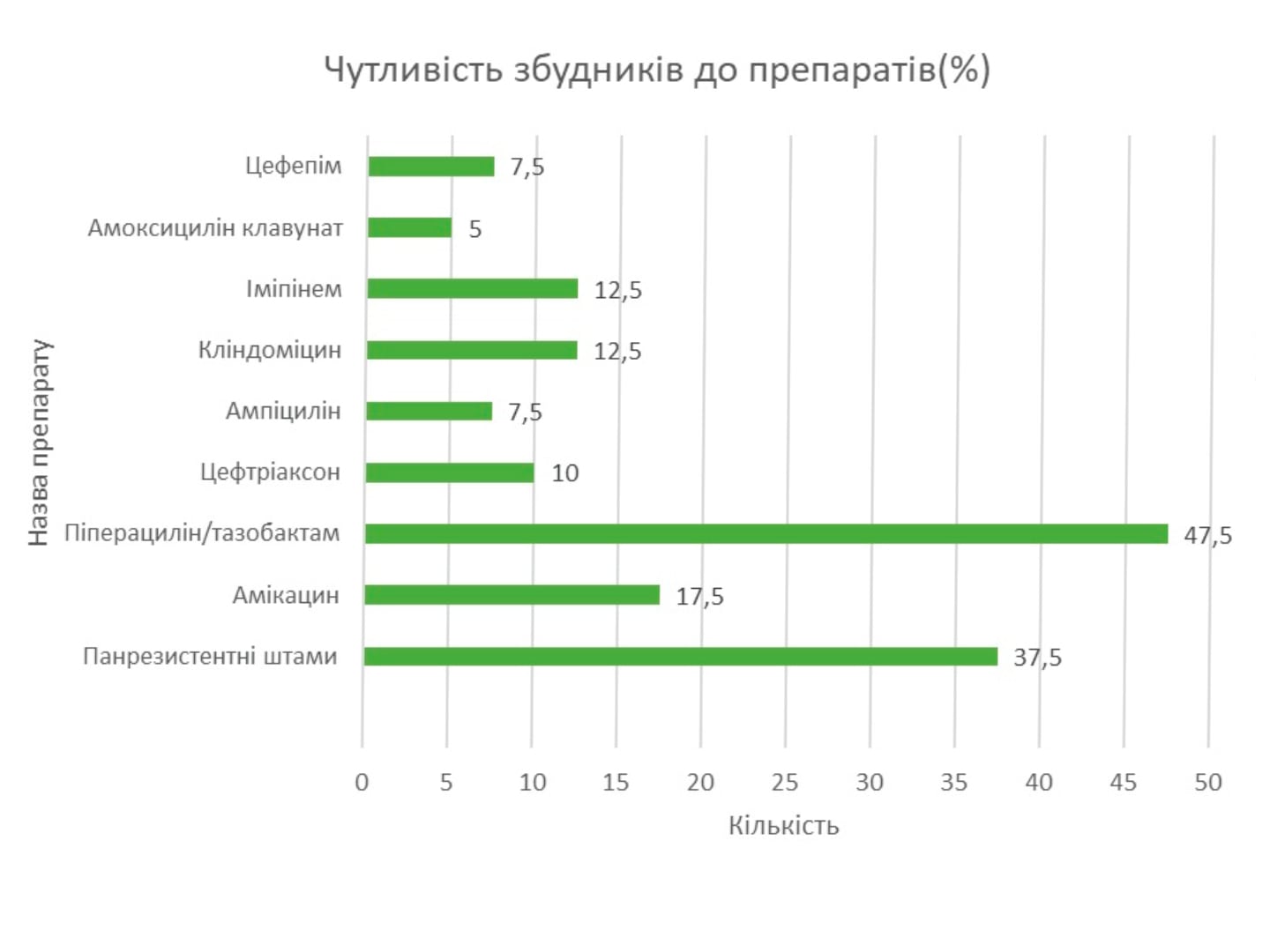
Результати проведення дослідження чутливості збудників на препарат виявили наступні результати: 2 випадки (5 %) були чутливі до амоксициліну клавунату. До ампіциліну та цефепіму були чутливі по 3 випадки (7,5 %) збудників. 4 випадки (10 % збудників) були чутливі до цефтріаксону. До іміпенему та кліндаміцину були чутливі по 12,5 % збудників (по 5 випадків). 7 випадків були чутливими до амікацину (17,5 %). До піперециліну/тазобактаму були чутливі 47,5 % флори (19 випадків).
Висновки: терапія піперациліном / тазобактамом (Рефексом) у проаналізованій серії клінічних випадків не потребувала заміни препарату, була позитивно оцінена лікуючими лікарями. Всі пацієнти вижили та були виписані зі стаціонару, у жодного з них не розвинувся сепсис або гостре ушкодження нирок. Серед проаналізованих випадків найвищою була чутливість до піперациліну/тазобактаму.
Ключові слова: піперацилін / тазобактам, інтраабдомінальні інфекції, антибіотикорезистентність.
Вступ
Ускладнені інтраабдомінальні інфекції (УІАІ) є поширеними невідкладними хірургічними станами і є основною причиною нетравматичних смертей у відділеннях невідкладної хірургічної допомоги по всьому світу [1].
Проблемою ефективного лікування УІАІ є раннє розпізнавання, адекватний контроль джерела, відповідна антибактеріальна терапія та рідинна ресусцитація у пацієнтів з сепсисом. Результати опублікованих клінічних досліджень часто можуть не відображати справжніх показників захворюваності та смертності від таких важких інфекцій.
По-перше, у клінічних дослідженнях зазвичай представлені переважно пацієнти з перфорованим апендицитом, що мають кращу виживаність порівняно з іншими УАІ.
По-друге, пацієнти з УАІ, які брали участь у клінічних дослідженнях, часто мають підвищену ймовірність одужання. Це пов’язано з тим, що вибіркові критерії включення у дослідження зазвичай виключають пацієнтів із супутніми захворюваннями та іншими факторами, які асоціюються зі смертю від УІАІ [1]. У дослідженні WISS [1], яке охоплювало всіх пацієнтів старше 18 років з УІАІ, загальна смертність становила 9,2 % (416/4533).
Антибіотикотерапія є одним із ключових компонентів лікування УАІ. Нещодавно в Україні було затверджено Інструкцію з адміністрування антимікробних препаратів [2] та розпочалося впровадження інфекційного контролю з метою зниження антибіотикорезистентності. Згідно з Інструкцією препаратами вибору для емпіричної терапії УАІ можуть бути піперацилін / тазобактам, захищені цефалоспорини, карбапенеми.
За рекомендаціями ВООЗ саме піперацилін / тазобактам є антибіотиком першої лінії для лікування ускладнених інтраабдомінальних інфекцій [3], проте в Україні цей препарат значимо рідше стає першим вибором для лікування УАІ. Карбапенеми, імовірно, призначають найбільш часто, що призвело до суттєвого зростання резистентності до карбапенемів в останні роки. Крім того, наразі відсутні національні дані щодо результатів лікування УАІ, інцидентності та ефективності тих чи інших схем антибіотикотерапії, типу флори та її чутливості до АБ.
Мета дослідження
Провести ретроспективний аналіз результатів лікування серії клінічних випадків УАІ з використанням піперациліну / тазобактаму (Рефексу) в лікарнях України.
Методи та матеріали
Дослідження було проведено у період з 1 грудня 2022 по 30 червня 2023. Центрами дослідження були 6 закладів охорони здоров’я:
- КНП «Київська міська клінічна лікарня швидкої медичної допомоги», м. Київ.
- КНП «Лікарня швидкої медичної допомоги», м. Вінниця.
- КНП «Одеська обласна клінічна лікарня Одеської обласної ради», м. Одеса,
- КНП «Київська міська клінічна лікарня №4», м. Київ.
Етична перевірка дизайну дослідження проводилась етичними комісіями у центрах дослідження та затверджувалась адміністрацією лікарні. Оскільки терапія, що проводилась у серії випадків відповідала новим клінічним протоколам та Стандарту з Інструкції МОЗ [2], це не потребувало додаткового затвердження за заключенням комісій центрів дослідження.
Критерії включення
Діагноз гострого перитоніту (К65.0) або інші види перитоніту (К65.8), перитоніт неуточнений (К65.9), гострий апендицит з перитонітом (К35.0), дивертикулярна хвороба тонкого (К57.4) або товстого (К57.2) кишківника з перфорацією та абсцесом та наявність наступних критеріїв:
- вік пацієнта більше 18 років;
- підписана інформована згода;
- перитоніт по етіології: первинний, вторинний, третинний;
- перитоніт по фазам клінічного перебігу: реактивна фаза (відсутність сепсису);
- перитоніт по характеру ексудату: серозний, гнійний, фібринозний та перехідні форми
- самостійне дихання та збережена свідомість у пацієнта.
Абсолютні критерії виключення:
- алергія на піперацилін / тазобактам;
- сепсис та гострі органні дисфункції;
- етіологія перитоніту: туберкульозний;
- важка супутня патологія (хронічна серцева недостатність, хронічна ниркова недостатність, хронічна печінкова недостатність).
Відносні критерії виключення:
- інші антибіотики були призначені за 12-48 годин.
Після включення у дослідження пацієнтам призначали емпіричну терапію піперациліном / тазобактамом (Рефекс) та вносили дані пацієнта у бланк дослідження та потім в електронну базу. Лікуючий лікар самостійно визначав покази, протипокази та дозування препарату згідно інструкції та протоколів. Протягом періоду лікування лікуючий лікар заповнював решту даних щодо результатів бактеріологічного дослідження середовища, ефективності лікування тощо. Інформація, яку збирали щодо кожного пацієнта у дослідженні приведена нижче:
- *паспортні дані / ідентифікаційні дані (номер пацієнта, номер історії хвороби);
- *вік;
- *стать;
- *д/з повний клінічний;
- *супутні захворювання;
- *операція, яка була виконана / або будуть виконані;
- *дату старту терапії, дату закінчення – тривалість антибіотикотерапії, дозування та шлях введення ЛЗ;
- *лабораторні показники (дні: 0, 3, 6 + кінець лікування – вказувати дату проведення);
- лейкоцити;
- маркери запалення (прокальцитонін, С-реактивний білок);
- *ефективність лікування (антибіотикотерапії): успішно, неуспішно (деталізація, чому? … (заміна а/б, розвиток ПДЛ);
- *виживаність пацієнтів (вижив – так/ні);
- *тривалість лікування в стаціонарі / ВАІТ;
- *потреба в повторних операціях (Чи потребував пацієнт повторних операцій після а/б терапії?);
- *побічні ефекти (з інструкції ті, що найчастіше зустрічаються);
- *розвиток сепсису / ГНН (так/ні);
- оцінка за шкалою APACHI / SOFA;
- важлива інформація, яку ви вважаєте необхідно подати;
- *посів: який збудник висіявся, яка чутливість (до чого), дата посіву.
Примітка «*» – обов’язкове до заповнення поле.
Фіксувались результати терапії препаратом до початку терапії (0 день), на 3-й день після початку терапії та на 6-й день від початку терапії. Порівнювались такі показники: середній рівень лейкоцитів, середній рівень прокальцитоніну, як маркерів запального процесу в організмі. А також середній бал за шкалами APACHE та SOFA.
Після завершення випадку лікуючий лікар вносив дані включеного пацієнта в електронну таблицю Google forms, яка містила аналогічну інформацію, як і паперова форма.
Після закінчення періоду дослідження всі заповнені дані були перенесені у Excel таблицю та проаналізовані за допомогою описової статистики для параметричних даних.
Результати
У дослідження було включено 40 пацієнтів з середнім віком 57.18 ± 17.51 років, серед них 17 чоловіків та 23 жінки (табл. 1).
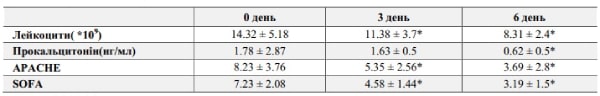
Динаміка лабораторних маркерів запалення та важкості пацієнтів за шкалами APACHE та SOFA приведені у Табл.2. До початку терапії: середній рівень лейкоцитів на початку терапії (0 день) складав 14.32*109± 5.18. Середній рівень прокальцитоніну на початку терапії (0 день) складав 1.78 нг/мл ± 2.87. Середній бал за шкалою APACHE 8.23 ± 3.76, за шкалою SOFA 7.23 ± 2.08.
На 3-й день терапії: середній рівень лейкоцитів в середині терапії складав 11.38*109 ± 3.7. Середній рівень прокальцитоніну в середині терапії складав 1.63 нг/мл ± 2.51. Середній бал за шкалою APACHE 5.35 ± 2.56, за шкалою SOFA 4.58 ± 1.44.
На 6-й день терапії: середній рівень лейкоцитів в середині терапії складав 8.31 ± 2.42. Середній рівень прокальцитоніну складав 0.62 ± 0.53. Середній бал за шкалою APACHE 3.69 ± 2.75, за шкалою SOFA 3.19 ± 1.52.
Під час опитування лікарів 40 з 40 (100 %) вказали, що терапія препаратом була успішною. Cередня тривалість терапії складала 7.58 ± 3.05 днів. Обраним дозуванням у всіх випадках було 12 г піперациліну /добу або 3 фл в/в.
У групі досліджуваних фіксувалась 14-денна виживаність пацієнтів. Цей показник склав 100 % (40 з 40 пацієнтів). Середня тривалість лікування пацієнтів у відділенні ВАІТ, серед усіх пацієнтів, які потребували інтенсивної терапії склала 7.58 ± 3.05 діб. Середня тривалість лікування всіх пацієнтів у стаціонарі склала 11.78± 11.31 діб. При цьому жоден (0 %) пацієнт з групи дослідження не потребував повторного хірургічного втручання. Діагноз сепсис або гостре ураження нирок (ГУН) не було зафіксовано у жодному з випадків. Також побічних ефектів виявлено не було (табл. 3).
Таблиця 1. Демографічні показники, найбільш поширені діагнози та супутні хвороби серед вибірки досліджуваних.
Таблиця 2. Динаміка лабораторних маркерів запалення та важкості стану пацієнтів під час лікування Рефексом. Дані представлені як M±SD.
 Примітка: *p<0.005.
Примітка: *p<0.005.
Таблиця 3. Тривалість та інші результати лікування пацієнтів препаратом піперацілін / тазобактам (Рефекс).
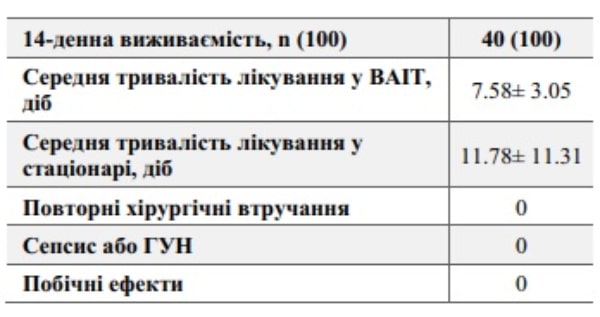
Серед збудників, що були висіяні під час бактеріологічного дослідження виділень з ран пацієнтів, до групи «ESKAPE» [4] відносились 24 випадки (60 %) збудників: E. Coli 9 випадків (22,5 %),S. Aureus 1 випадок (2,5 %), St. Haemolyticus склав 3 випадки (7,5 %), Kl. Pneumonia 4 випадки (10 %), Acinetobacter spp. 1 випадок (2,5 %), Ps. Aerоginosa 3 випадки (7,5 %), Enterobacter 1 випадок (2,5 %), Enterbacter cloaceae склав 2 випадки (5 %).
Інші збудники склали 16 випадків, з них: Proteus Mirabilis склав 2 випадки (5 %), Citrobacter 1 випадок (2,5 %). Було зафіксовано 3 випадки змішаної флори (Clostridium, Е.coli), (Enterococus spp. Klebsiella pneum.), (Enterobacter aerogenes , E. Coli). Також у групі дослідження 10 (25 %) випадків, серед яких флора не була виявлена, проте були наявні клінічні ознаки розвитку інфекційного процесу (Діаграма 1).
Результати проведення дослідження чутливості збудників на препарат виявили наступні результати: 2 випадки (5 %) були чутливі до амоксициліну клавунату. До ампіциліну та цефепіму були чутливі по 3 випадки (7,5 %) збудників. 4 випадки (10 % збудників) були чутливі до цефтріаксону. До іміпінему та кліндаміцину були чутливі по 12,5 % збудників (по 5 випадків). 7 випадків були чутливими до амікацину (17,5 %). До піперециліну/тазобактаму були чутливі 47,5 % флори (19 випадків).
Панрезистентні штами, що були нечутливими до жодного з досліджуваних препаратів склали 37,5 % (15 випадків) (Діаграми 2, 3). Панрезистентність було виявлено у Enterobacter aerogenes в 1 з випадків, Enterbacter cloaceae в 1 з випадків, E. Coli в 1 з випадків й Acinetobacter spp. в 1 з випадків. У 8 випадках панрезистентності збудник не виявлений, і в 1 випадку була змішана флора (Enterobacter aerogenes, E. Coli).
Дискусія
У дослідженні Всесвітнього товариства хірургічних інфекцій (WSIS) рівень смертності 4553 пацієнтів із ускладненими інтраабдомінальними інфекціями становив 9,2 % [1]. Пацієнти з тривалими IAI частіше страждають від серйозних метаболічних порушень і виснаження. Це призводить до тривалого перебування у відділенні інтенсивної терапії (ВАІТ), що призводить до хронізації захворювання та збільшення тривалості одужання із загальними небажаними результатами у віддаленій перспективі [5]. За останні 15 років смертність після хірургічного сепсису суттєво знизилася завдяки ранньому скринінгу сепсису та запровадженню науково-обґрунтованої допомоги у відділенні інтенсивної терапії [5].
Багато пацієнтів, які раніше перенесли септичний шок і згодом поліорганну недостатність, тепер виживають і потребують лікування з тривалим курсом інтенсивної терапії, великим використанням ресурсів і стійкою, але контрольованою недостатністю органів. Ці пацієнти мають синдром постійного запалення, імуносупресії та катаболізму. Майже всіх виписують з закладів з необхідністю подальшої реабілітації, проте це все одно загрожує негативними віддаленими результатами.
Діаграма 1. Частота виявлення збудників за результатами бактеріологічного дослідження вмісту черевної порожнини.
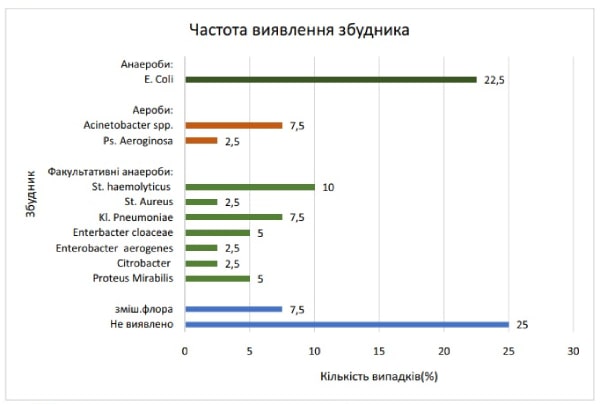
Діаграма 2. Чутливість збудників до препаратів.
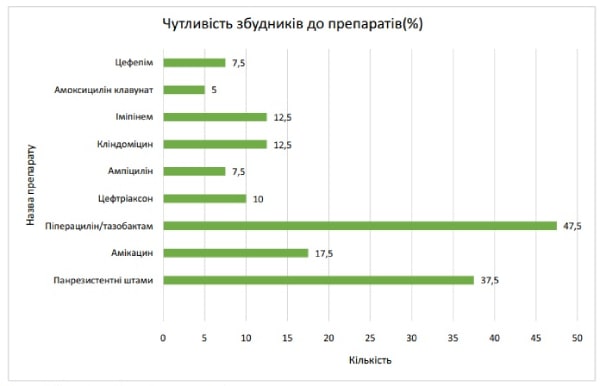
Діаграма 3. Розподіл збудників відповідно до препаратів.
У дослідженні Європейського товариства інтенсивної терапії [6] загальна поширеність резистентності до антимікробних препаратів становила 26,3 %, а грамнегативних бактерій, які важко піддаються лікуванню, – 4,3 %, із великими варіаціями залежно від географічного регіону. Не спостерігалося жодної різниці в поширеності антимікробної резистентності залежно від місця зараження. Загальна смертність склала 29,1 %.
Незалежні фактори ризику смертності включали внутрішньолікарняну інфекцію з пізнім початком, дифузний перитоніт, сепсис, септичний шок, літній вік, недоїдання, печінкову недостатність, застійну серцеву недостатність, резистентність до антимікробних препаратів (метицилінрезистентний Staphylococcus aureus, ванкоміцинрезистентний ентерокок, грамнегативні бактерії розширеного спектру дії, що продукують бета-лактамазу, або карбапенем -резистентні грамнегативні бактерії) і невдача контролю над джерелом, про що свідчить або необхідність хірургічного перегляду, або стійке запалення.
В Україні середня летальність від поширених форм перитоніту в даний час складає 30 %, досягаючи при ускладненнях поліорганною недостатністю (ПОН), септичним шоком, а також при післяопераційному перитоніті у літніх пацієнтів 40–83,4 % [7, 8]. Дослідження препарату відбувалось у всьому світі, починаючи з 1993 року [9, 10].
Емпірична антибіотикотерапія для пацієнтів з ІАІ повинна включати агенти з активністю проти аеробних грамнегативних бактерій (наприклад, Enterobacteriaceae), аеробних стрептококів та облігатних ентеральних анаеробних мікроорганізмів, виявлених у шлунково-кишковому тракті, хоча застосування останніх може не бути абсолютно необхідним для пацієнтів із вогнищем інфекції у верхніх відділах шлунково-кишкового тракту.
Як правило, найважливішими факторами для прогнозування наявності резистентних збудників ІАІ є перебування в медичному закладі (зокрема, якщо пацієнт інфікується у відділенні інтенсивної терапії або був госпіталізований більше 1 тижня), використання кортикостероїдів, трансплантація органів, первинне захворювання легенів або печінки та попередня антибактеріальна терапія [12].
За останні два десятиліття резистентність до антимікробних препаратів стала глобальною загрозою для систем охорони здоров’я та однією з найпоширеніших причин нераціонального використання антибіотиків, а також недостатньої профілактики та контролю інфекційних захворювань.
Зокрема, інфекції, спричинені резистентними грамнегативними бактеріями, стають все більш поширеними і зараз становлять серйозну загрозу для громадського здоров’я в усьому світі, оскільки їх важко лікувати та пов’язано з високим рівнем захворюваності та смертності. Карбапенемази, що продукують бактерії, такі як K. pneumoniae, швидко стають основним джерелом мультирезистентних інфекцій у всьому світі [13] і становлять серйозну загрозу в клінічних ситуаціях, коли введення ефективних емпіричних антибіотиків є важливим для запобігання смертності після бактеріємії та інфекцій у пацієнтів з ослабленим імунітетом.
Неферментуючі грамнегативні бактерії (P. aeruginosa, Stenotrophomonas maltophilia та Acinetobacter baumannii) показали високі показники підвищеної резистентності до різноманітних антибіотиків у закладах охорони здоров’я по всьому світу. Ці види є внутрішньо стійкими до кількох ліків і можуть набути додаткової стійкості до інших важливих антибактеріальних препаратів [12].
У контексті УАІ основна проблема резистентності породжена бета-лактамазами розширеного спектру дії (ESBL), що продукують Enterobacteriaceae, які тривожно переважають у нозокоміальних інфекціях і часто спостерігаються при позалікарняних інфекціях, хоча й меншою мірою [14]. ESBL є ферментами, здатними гідролізувати та інактивувати широкий спектр бета-лактамів, включаючи цефалоспорини третього покоління, пеніциліни та азтреонам [15]. УАІ можна лікувати за допомогою однієї або кількох схем лікування антибіотиками.
Комбінації бета-лактаму / інгібітору бета-лактамази, включаючи амоксицилін / клавуланат, тикарцилін / клавуланат, піперацилін / тазобактам, мають активність in vitro проти грампозитивних, грамнегативних та анаеробних бактерій. Підвищення рівня антимікробної резистентності до амоксициліну/клавуланату серед E. coli та інших Enterobacteriaceae у всьому світі протягом останнього десятиліття поставило під загрозу клінічну корисність цього препарату для емпіричної терапії серйозних грамнегативних інфекцій, тому його слід використовувати на основі місцевих рівнів резистентності [12, 14].
Широкий спектр дії піперациліну / тазобактаму, включаючи антисиньогнійну та анаеробну дію, все ще робить його привабливим варіантом у лікуванні тяжких УАІ.
З 40 (100 %) випадків УАІ, що були включені до нашого дослідження виявлено 10 (25 %) випадків «чистих посівів», тобто відсутність росту мікрофлори, що може свідчити про проблеми під час забору середовища для посіву. Зазвичай при відсутності росту флори клінічний випадок не враховують у результати дослідження, проте враховуючи наявність клінічних та лабораторних ознак розвитку інфекційного процесу, а в одному з випадків терапію піперациліну / тазобактаму були визнано як терапією відчаю, то було прийнято рішення брати в огляд дані випадки.
Рис.1. Принципи лікування та діагностики пацієнтів з УАІ [16].
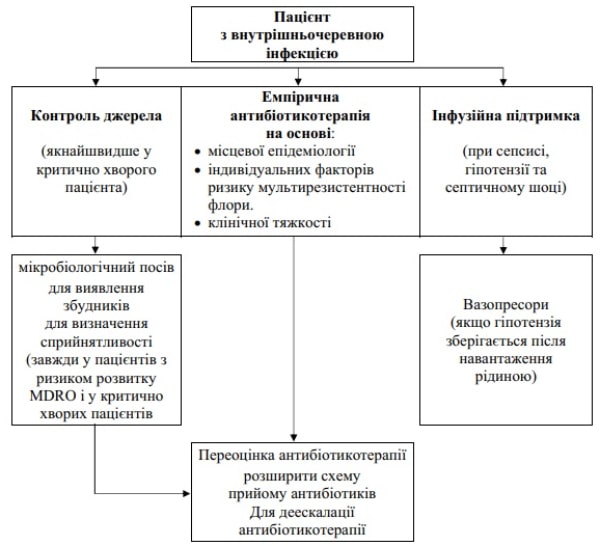
У нашому дослідженні летальність склала 0 %. У дослідженні CIAOW (Complicated intraabdominal infections worldwide observational study) – це багатоцентрове обсерваційне дослідження, проведене в 68 медичних установах по всьому світу протягом шестимісячного періоду дослідження (20 жовтня – 12 березня 2013 р.) [17] загальна летальність складала 10,5 % (199/1898). Це може бути пов’язане з невеликою кількістю вибірки для дослідження.
Середня тривалість госпіталізації пацієнтів у нашому дослідженні склала 283.45 ± 275.24 годин, при середньому рівні тривалості госпіталізації (в Україні – 11,8 днів, в ЄС – 8,08 днів). Це може бути пов’язано з обмеженою кількістю вибірки, та включення у дослідження пацієнтів з хронічним перебігом захворювання, яке, однак, потребує продовження лікування у стаціонарі.
Потреба у замісній нирковій терапії у нашому дослідженні склала 0 %. У дослідженні Гельман Т, Усало П., та інших від 23 вересня 2021 року вказано, що остання кампанія Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock, видана у 2016 році, не містить жодних рекомендацій щодо використання методів очищення крові у пацієнтів із сепсисом. Наразі показання до початку замісної ниркової терапії при септичній ГНН не відрізняються від ГНН іншої етіології. Використання спеціальних адсорбційних методів може бути розглянуто для додаткової терапії в кожному конкретному випадку.
Автори: Бєлка К.Ю., Фоміна Г.А., Гончаренко О.В., Згржебловська Л.В., Койчев Є.А., Малиш І.Р., Солярик С.О.
Висновки:
Терапія піперациліном / тазобактамом (Рефексом) у проаналізованій серії клінічних випадків не потребувала заміни препарату, була позитивно оцінена лікуючими лікарями. Всі пацієнти вижили та були виписані зі стаціонару, у жодного з них не розвинувся сепсис або гостре ушкодження нирок.
Серед проаналізованих випадків, найвищою була чутливість до піперациліну/тазобактаму – 47,5 % флори (19 випадків). Панрезистентні штами, що були не чутливими до жодного з досліджуваних препаратів склали 37,5 % (15 випадків).
Література:
- Sartelli M, Abu-Zidan FM, Catena F, Griffiths EA, Di Saverio S, Coimbra R, et al. Global validation of the WSES Sepsis Severity Score for patients with complicated intraabdominal infections: a prospective multicenter study (WISS Study). World J Emerg Surg. 2015;10(1):61.
- ІНСТРУКЦІЯ з впровадження адміністрування антимікробних препаратів в закладах охорони здоров’я, які надають медичну допомогу в стаціонарних умовах [Електронний ресурс]. – 2021. – Режим доступу до ресурсу: rada.gov.ua/laws/show/z1322-21#Text
- Ombajo L. A. WHO Model Lists of Essential Medicine [Електронний ресурс] / Ombajo. – 2023. – Режим доступу до ресурсу: essentialmeds.org/medicines/320
- Santajit S, Indrawattana N. Mechanisms of Antimicrobial Resistance in ESKAPE Pathogens. Biomed Res Int. 2016;2016:2475067. doi: 10.1155/2016/2475067.
- Cox MC, Brakenridge SC, Stortz JA, Hawkins RB, Darden DB, Ghita GL, et al. Abdominal sepsis patients have a high incidence of chronic critical illness with dismal long-term outcomes. Am J Surg. 2020;220(6):1467–74.
- Stijn Blot,1Massimo Antonelli,2,3 Kostoula Arvaniti,4 Koen Blot,1 Ben Creagh-Brown,5,6Intensive Care Med. 2019; 45(12): 1703–1717. Published online 2019 Oct 29. doi: 1007/s00134-019-05819-3 PMCID: PMC6863788 PMID: 31664501
- Фомін П. Д.Нерадикальні операції в хірургічному лікуванні гострокровоточивих злоякісних пухлин шлунка / П. Д. Фомін, П. В. Іванчов // Військова медицина України. – 2011. – Т. 11, № 1. – С. 62-66. – Режим доступу: gov.ua/UJRN/vmuk_2011_11_1_11
- Мамчич В. И.Особенности диагностики и лечения острого панкреатита у беременных / В. И. Мамчич, О. В. Голяновский, И. В. Кандаурова, Т. Ю. Пилипенко, М. А. Йосипенко, Ю. О. Литвинец // Хірургія України. – 2015. – № 4. – С. 28-32. – Режим доступу: gov.ua/UJRN/KhU_2015_4_6
- Polk HC Jr, Fink MP, Laverdiere M, Wilson SE, Garber GE, Barie PS, Hebert JC, Cheadle WG. Prospective randomized study of piperacillin/tazobactam therapy of surgically treated intra-abdominal infection. The Piperacillin/Tazobactam Intra-Abdominal Infection Study Group. Am Surg. 1993 Sep;59(9):598-605. PMID: 8396374.
- Results of the North American trial of piperacillin/tazobactam compared with clindamycin and gentamicin in the treatment of severe intra-abdominal infections. Investigators of the Piperacillin/Tazobactam Intra-abdominal Infection Study Group. Eur J Surg Suppl. 1994;(573):61-6. PMID: 7524798.
- Протокол надання медичної допомоги хворим на негоспітальну та нозокоміальну (госпітальну) пневмонію у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антибактеріальна терапія. Затверджений наказом МОЗ України від 19 березня 2007 р. № 128. Доступно за адресою: ifp.kiev.ua/doc/staff/MOZ-128-19032007.pdf.
- Sartelli M, Weber DG, Ruppé E, Bassetti M, Wright BJ, Ansaloni L, et al. Antimicrobials: a global alliance for optimizing their rational use in intra-abdominal infections (AGORA). World J Emerg Surg. 2016;11(1):33. org/10.1186/s13017-016-0089-y.
- Nordmann P, Cuzon G, Naas T. The real threat of Klebsiella pneumoniae carbapenemase-producing bacteria. Lancet Infect Dis. 2009;9(4):228–36. org/10.1016/S1473-3099(09)70054-4.
- Morrissey I, Hackel M, Badal R, Bouchillon S, Hawser S, Biedenbach D. A review of ten years of the study for monitoring antimicrobial resistance trends (SMART) from 2002 to 2011. Pharmaceuticals (Basel). 2013;6(11):1335–46. org/10.3390/ph6111335.
- Schultsz C, Geerlings S. Plasmid-mediated resistance in Enterobacteriaceae: changing landscape and implications for therapy. Drugs. 2012;72(1):1–16.
- Sartelli, M., Coccolini, F., Kluger, Y. et al.WSES/GAIS/SIS-E/WSIS/AAST global clinical pathways for patients with intra-abdominal infections. World J Emerg Surg 16, 49 (2021). org/10.1186/s13017-021-00387-8.
- Sartelli M, Catena F, Ansaloni L, Coccolini F, Corbella D, Moore EE, Malangoni M, Velmahos G, Coimbra R, Koike K, Leppaniemi A, Biffl W, Balogh Z, Bendinelli C, Gupta S, Kluger Y, Agresta F, Di Saverio S, Tugnoli G, Jovine E, Ordonez CA, Whelan JF, Fraga GP, Gomes CA, Pereira GA, Yuan KC, Bala M, Peev MP, Ben-Ishay O, Cui Y, Marwah S, Zachariah S, Wani I, Rangarajan M, Sakakushev B, Kong V, Ahmed A, Abbas A, Gonsaga RA, Guercioni G, Vettoretto N, Poiasina E, Díaz-Nieto R, Massalou D, Skrovina M, Gerych I, Augustin G, Kenig J, Khokha V, Tranà C, Kok KY, Mefire AC, Lee JG, Hong SK, Lohse HA, Ghnnam W, Verni A, Lohsiriwat V, Siribumrungwong B, El Zalabany T, Tavares A, Baiocchi G, Das K, Jarry J, Zida M, Sato N, Murata K, Shoko T, Irahara T, Hamedelneel AO, Naidoo N, Adesunkanmi AR, Kobe Y, Ishii W, Oka K, Izawa Y, Hamid H, Khan I, Attri A, Sharma R, Sanjuan J, Badiel M, Barnabé R. Complicated intra-abdominal infections worldwide: the definitive data of the CIAOW Study. World J Emerg Surg. 2014 May 14;9:37. doi: 10.1186/1749-7922-9-37. PMID: 24883079; PMCID: PMC4039043.