Интравезикальные инстилляции высокомолекулярного гиалуроната натрия при радиационном цистите: проспективное пилотное исследование
Аннотация
Цель: Оценить эффективность и безопасность интравезикальных инстилляций высокомолекулярной гиалуроновой кислоты (ВМГК) для лечения радиационного цистита.
Методы: Это проспективное когортное исследование было проведено в семи центрах во Франции. Набор подходящих пациентов с радиационным циститом осуществлялся в период с апреля 2020 г. по март 2021 г. Еженедельно выполняли инстилляции в мочевой пузырь стерильного одноразового предварительно наполненного раствора объемом 50 мл, содержащего 0,16% (80 мг/50 мл) ВМГК (ИНСТИЛАН). Курс лечения состоял из 6 сеансов (от V1 до V6).
Конечные точки оценивали через 1 неделю (V7) и 4 недели (V8) после последнего сеанса и сравнивали с исходным уровнем (V0). Первичной конечной точкой была боль в мочевом пузыре, которую оценивали с помощью опросника с 5 стереотипными вариантами ответа. Вторичные конечные точки включали изменения по сравнению с исходным уровнем гематурии, частоты мочеиспускания и влияния императивных позывов к мочеиспусканию на качество жизни (КЖ). Нежелательные явления (НЯ) ранжировали в соответствии с классификацией CTCAE 3.0.
Результаты: Для участия было зарегистрировано в общей сложности 30 участников. Анализ всех рандомизированных пациентов показал значительное снижение интенсивности тазовой боли (-45,81%, p<0,001), гематурии (-26,87%, p=0,008), общего количества мочеиспусканий за 24 часа (-23,92%, p<0,001) и влияния императивных позывов к мочеиспусканию на КЖ (-33,92%, p<0,001) во время визита V7. В период между V7 и V8 после завершения лечения по-прежнему наблюдались результаты, достигнутые для каждой конечной точки. Была отмечена хорошая переносимость интравезикальных инстилляций: сообщалось о двух НЯ (6,6%), связанных с лечением, которые представляли собой гематурию 1-й степени тяжести.
Результати: У дослідження було включено 30 пацієнтів. Аналіз за вибіркою «пацієнти, що мають намір лікуватись» показав суттєве зниження ступеня тазового болю (- 45,81%, р<0,001), гематурії (- 26,87%, p<0,008), добового діурезу (- 23,92%, p<0,001) та впливу позивів на якість життя (- 33,92%, p<0,001) у точці V7. Покращення залишалось стабільним по кожному результату після лікування в період між точками V7 та V8. Лікування внутрішньоміхуровими інстиляціями добре переносилось пацієнтами: повідомлялось про два (6,6%) НЯ, пов’язаних з лікуванням, які відповідали двом випадками гематурії 1 ступеня.
Результаты: В исследование были включены 30 пациентов. Анализ по выборке «намеренные лечиться» показал существенное снижение в выраженности тазовой боли (- 45,81%, р<0,001), гематурии (- 26,87%, p<0,008), суточном диурезе (- 23,92%, p<0,001) и влиянии позывов на качество жизни (- 33,92%, p<0,001) в точке V7. Улучшение оставалось стабильным по каждому результату после лечения в период между точками V7 и V8. Лечение внутрипузырными инстилляциям хорошо переносилось пациентами: сообщалось о двух (6,6%) НЯ, связанных с лечением, которые соответствовали двум случаям гематурии 1 степени.
Заключение: Интравезикальные инстилляции ВМГК эффективны в лечении радиационного цистита. Для подтверждения наших предварительных результатов необходимое проведение дальнейших сравнительных исследований с более длительным периодом наблюдения.
Ключевые слова: Гиалуронат натрия, интравезикальная инстилляция, радиационный цистит, боль в мочевом пузыре, гематурия.
Мы хотели бы отдать дань памяти господину Франсуа Шутцу (Mr. Francois Schutz), главе «ЛИДДЕ Терапевтикс» (LIDDE Therapeutics).
Введение
Наружная лучевая терапия органов малого таза является важным инструментом в терапевтическом арсенале для лечения рака органов малого таза [1]. Однако мочевой пузырь является критическим органом, который может быть чувствителен даже к низким дозам облучения. Несмотря на усовершенствование техник, облучение органов малого таза по-прежнему является причиной развития острых и/или отложенных нежелательных явлений со стороны мочевовыводящих путей.
Радиационный цистит представляет собой стерильный цистит неинфекционного происхождения, характеризующийся диффузным кровотечением из слизистой оболочки мочевого пузыря. Предполагаемая частота радиационного цистита в этой популяции, подвергшейся облучению, колеблется от 5 до 20% [2]. Симптомы включают боль в мочевом пузыре, гематурию, учащенное мочеиспускание, императивные позывы к мочеиспусканию и недержание мочи, которые снижают качество жизни (КЖ) пациентов, при этом с течением времени ситуация может ухудшиться [3].
Лечение радиационного цистита является сложной задачей. Описаны различные варианты лечения [4]. Гипербарическая оксигенотерапия (ГБОТ) является наиболее изученным вариантом лечения персистирующей или рецидивирующей клинически значимой гематурии. Однако такая терапия требует проведения в общей сложности от 30 до 40 сеансов в течение 8-недельного периода, при этом часто возникают рецидивы [5, 6].
Были предложены альтернативные консервативные методы лечения, например, интравезикальные инстилляции гиалуроновой кислоты [7]. ГК является компонентом слоя гликозаминогликанов, который находится в субэпителиальном слое стенки мочевого пузыря в высоких концентрациях. Интравезикальная инстилляция высокомолекулярной гиалуроновой кислоты (ВМГК), препарата ИНСТИЛАН (INSTYLAN) (Диако Биофармасьютичи С.Р.Л., Триест, Италия (Diaco Biofarmaceutici S.R.L., Trieste, Italy)), позволяет создать вязкоупругую мембрану на поверхности слизистой оболочки, защищает и способствует регенерации поврежденного уротелия [8, 9].
Цель исследования заключалась в получении дополнительных данных о влиянии инстилляций ВМГК на симптомы радиационного цистита.
Материалы и методы
Дизайн и участники исследования
Это многоцентровое проспективное когортное исследование было проведено в соответствии с правилами надлежащей клинической практики и принципами Хельсинкской декларации в период с апреля 2020 г. по март 2021 г. Протокол исследования и поправки были одобрены Комитетом по защите личности: CPP Sud-Est VI—Clermont Ferrand.
Набор пациентов осуществлялся в семи центрах во Франции. Спонсор (компания «ЛИДДЕ Терапевтикс САС» (LIDDE Therapeutics SAS)), КИО и компания по обработке данных (Easy-CRF SAS) несли ответственность за общее управление исследованием и сбор данных (єИРФ) в сотрудничестве с главным исследователем, который провел статистический анализ вместе с одним из авторов. Рукопись была подготовлена одним из авторов независимо от компании «ЛИДДЕ Терапевтикс САС».
Пациенты имели право на участие, если они соответствовали таким критериям, как возраст ≥18 лет и наличие отложенных симптомов (>1 года после лучевой терапии) радиационного цистита, вызванного лучевой терапией органов малого таза. Критерии включения: боль в мочевом пузыре и минимум еще один симптом со стороны мочевыводящих путей, то есть императивные позывы к мочеиспусканию, гематурия или учащенное мочеиспускание.
Предшествующее пероральное лечение, например прием антихолинергических препаратов, не было критерием исключения, если такое лечение было прекращено до включения в исследование. Критерии исключения: неврологический мочевой пузырь, сакральная нейромодуляция, инфекция нижних мочевыводящих путей, объем остаточной мочи после мочеиспускания >200 мл, клинически значимое сердечно-сосудистое заболевание в течение последних шести месяцев и продолжающееся лечение, включая ГБОТ, восполнение гликозаминогликанов, лучевую терапию, брахитерапию или инстилляции БЦЖ/митомицина С.
Протокол
Во время скринингового визита (V0) все пациенты прошли осмотр для проверки критериев отбора. Все участники получили информацию в письменном виде и подписали согласие на участие. Инстилляции в мочевой пузырь выполняли в соответствии с указаниями, приведенными в инструкции производителя (Диако Биофармасьютичи С.Р.Л., Триест, Италия).
Вкратце, процедура представляет собой инстилляции в мочевой пузырь стерильного одноразового предварительно наполненного раствора объемом 50 мл, содержащего 0,16% (80 мг/50 мл) ВМГК (ИНСТИЛАН), с помощью стерильного катетера Фолея размером 14–16. Пациентов уведомили о необходимости удерживать раствор не менее 1 часа. Курс лечения состоял из 6 еженедельных сеансов (V1–V6). Поддерживающие процедуры не были запланированы.
Показатели
Показатели оценивались пациентом (показатель результата, сообщаемый пациентом) и врачом через 1 неделю (V7) и 4 недели (V8) после последнего сеанса и сравнивались с исходным уровнем (V0). Первичной конечной точкой была боль в мочевом пузыре, оцениваемая с помощью опросника с 5 стереотипными вариантами ответа, где 1 = отсутствие боли, 2 = легкая боль, 3 = умеренная боль, 4 = сильная боль и 5 = невыносимая боль.
Вторичные конечные точки включали изменения по сравнению с исходным уровнем других зарегистрированных симптомов со стороны мочевыводящих путей, таких как гематурия (1 = моча желтого цвета, 2 = моча розового цвета и 3 = моча красного или коричневого цвета), частота мочеиспускания, которую оценивали с помощью 24-часового дневника мочеиспускания, и влияние императивных позывов к мочеиспусканию на качество жизни (1–3 по ВАШ: 1 = отсутствие проблем/легкие проблемы, 2 = умеренные проблемы, 3 = серьезные проблемы).
Побочные эффекты оценивали во время еженедельных визитов и рассматривали отдельно как нежелательные явления (НЯ) и серьезные нежелательные явления (СНЯ). НЯ ранжировали в соответствии с классификацией Общих терминологических критериев нежелательных явлений (CTCAE), редакция 3.0.
Статистический анализ
Для расчета размера выборки мы предположили, что уменьшение боли в мочевом пузыре составит 30–50%, что основывалось на данных предыдущего исследования [10]. Используя значение α=0,05, мы рассчитали размер выборки на уровне n=16. Учитывая возможность преждевременного прекращения участия и различия в терапевтическом ответе в разных исследованиях, мы стремились набрать не менее 25 пациентов.
Анализы эффективности и безопасности были проведены в популяции всех рандомизированных пациентов (ITT) и в популяции пациентов, выполнивших требования протокола (PP). В случае прекращения лечения пациентом (в связи с отсутствием эффективности и развитием побочных эффектов или по личным причинам) в ITT-анализе применяли метод переноса данных последнего наблюдения (LOCF).
Описательная статистика была проведена по доступным переменным. Категориальные переменные были представлены как частота и процент (%), а непрерывные переменные — как среднее значение и стандартное отклонение (SD). Изменения по сравнению с исходным уровнем оценивали с помощью знакового рангового критерия Уилкоксона или t-критерия Стьюдента.
Закрытие базы данных состоялось (Easy-CRF) 20 мая 2021 года. Статистический анализ был выполнен с использованием R версии 4.0.2 (R Foundation for Statistical Computing, Вена, Австрия). P-значение менее 0,05 считалось статистически значимым. Исследование было зарегистрировано в базе ClinicalTrials.gov под номером NCT04696666.
Результаты
В период с апреля 2020 г. по март 2021 г. в семи центрах во Франции для участия было зарегистрировано в общей сложности 30 участников, которые составили ITT-популяцию. После исключения трех пациентов, у которых отсутствовала боль в мочевом пузыре во время V1, и одного пациента, выбывшего из исследования после двух инстилляций из-за гематурии 1-й степени, PP-популяция составила 26 пациентов. В таблице 1 приведены исходные характеристики ITT-популяции.
Средний возраст составил 75 лет (± 2,8), а 29 (96%) из 30 пациентов были мужчинами. В целом у 87% пациентов присутствовала боль в мочевом пузыре, у 46% была отмечена тяжелая гематурия, а среднее общее количество мочеиспусканий за 24 часа составило 12 (±1,2). Проблема императивных позывов к мочеиспусканию имела умеренное или серьезное влияние на КЖ 87% участников. Ранее ни один пациент не был госпитализирован из-за гематурии. Показаниям к лучевой терапии были рак предстательной железы в 29 случаях (96,7%) и рак шейки матки в 1 случае (3,3%). Медиана времени от завершения лучевой терапии до инстилляций мочевого пузыря составила 2,3 (2–2,7) года.
Клинические результаты
Во время V7 в ITT-популяции наблюдалось значительное снижение интенсивности боли по сравнению с исходным уровнем: 2,27 (±0,29) (V1) против 1,23 (±0,20) (V7) (–45,81%, p<0,001) (таблица 2). Что касается вторичных конечных точек, во время V7 было отмечено, что лечение привело к значительному улучшению гематурии и уменьшению влияния императивных позывов к мочеиспусканию на качество жизни (все p<0,01 по сравнению с исходным уровнем) (таблица 2). Дневники также подтвердили значительное снижение общего количества мочеиспусканий за 24 часа от исходного уровня до V7 [с 11,87 (±1,21) до 9,03 (±1,28)] мочеиспусканий, p<0,001).
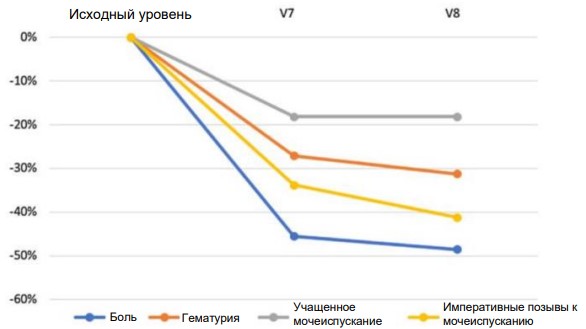
PP-анализ показал аналогичные результаты: показатель боли в мочевом пузыре снизился с начального среднего значения 2,46 (±0,27) (V1) до 1,19 (±0,18) в конце лечения (V7) со средним процентным изменением –51,62% (p<0,001). Это касается и других переменных, таких как гематурия (–34,54%, p<0,001), количество мочеиспусканий (–25,17%, p<0,001) и учащенное мочеиспускание (–37,44%, p<0,001). В период между V7 и V8 после завершения лечения по-прежнему наблюдались результаты, достигнутые для каждой конечной точки, и отмечалось некоторое улучшение показателей (рис. 1).
Таблица 1. Исходные характеристики (ITT-популяция)
 КЖ — качество жизни
КЖ — качество жизни
Безопасность
Была отмечена хорошая переносимость трансуретральной катетеризации и инстилляции мочевого пузыря. Всего было зарегистрировано два НЯ (6,6%), связанные с лечением. Они представляли собой два случая гематурии 1-й степени, что привело к исключению одного пациента из исследования. Ни одному пациенту не потребовалось переливание крови. Не наблюдалось серьезных НЯ.
Таблица 2. Клинические исходы
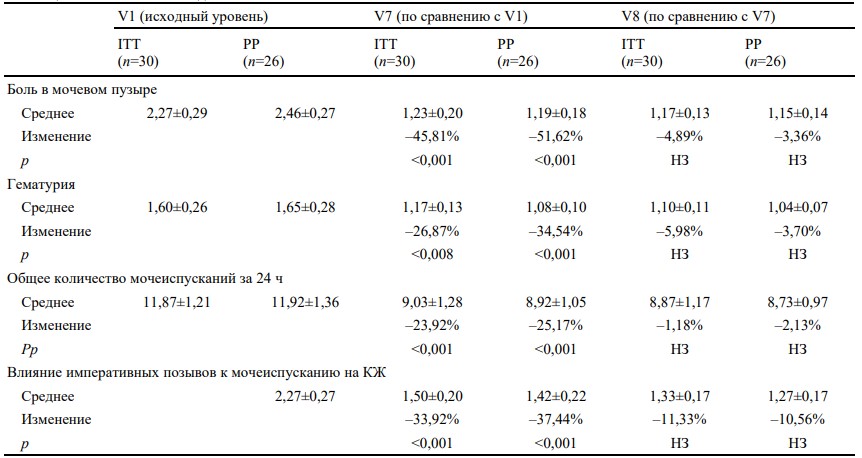 КЖ — качество жизни, ITT— все рандомизированные пациенты, PP — пациенты, выполнившие требования протокола, НЗ — незначимый, V7 — визит через неделю после последней инстилляции, V8 — визит через четыре недели после последней инстилляции
КЖ — качество жизни, ITT— все рандомизированные пациенты, PP — пациенты, выполнившие требования протокола, НЗ — незначимый, V7 — визит через неделю после последней инстилляции, V8 — визит через четыре недели после последней инстилляции
Рис. 1. Изменения показателей от исходного уровня
Обсуждение
Результаты нашего многоцентрового проспективного исследования подтверждают, что интравезикальные инстилляции ВМГК у пациентов с радиационным циститом, вызванным лучевой терапией органов малого таза, обеспечивает значительные клинические преимущества. Мы отметили значительные улучшения в популяциях ITT и PP по всем интересующим конечным точкам, включая боль в мочевом пузыре, гематурию, учащенное мочеиспускание и влияние императивных позывов к мочеиспусканию на качество жизни.
Было установлено, что лучевая терапия органов малого таза вызывает дефекты слизистой оболочки мочевого пузыря, что приводит к хроническим воспалительным изменениям и задержке или предотвращению заживления уротелиальных клеток [11]. ВМГК — это новая интравезикальная терапия, направленная на восполнение защитного слоя гликозаминогликанов, чтобы уменьшить воздействие мочи на нижележащие эпителиальные клетки [12].
Наше пилотное исследование подтверждает обнадеживающие результаты, полученные в предыдущих исследованиях восполняющей терапии с использованием ГК при различных заболеваниях, таких как интерстициальный цистит/синдром болезненного мочевого пузыря [13-15], цистит, вызванный интравезикальной иммунохимиотерапией [16], геморрагический цистит после трансплантации гемопоэтических стволовых клеток [17] и рецидивирующий бактериальный цистит [18]. Таким образом, инновационная жизнеспособная концепция инстилляций ВМГК способствует ее более широкому использованию при лечении радиационного цистита.
В настоящее время ГБОТ является наиболее изученным вариантом лечения персистирующей или рецидивирующей клинически значимой гематурии. Результаты многочисленных исследований подтверждают безопасность и эффективность ГБОТ, поэтому ее следует рассматривать как ранний вариант лечения радиационного цистита у пациентов с явными симптомами. ВМГК сравнивали с ГБОТ в предыдущем РКИ [10]. Пациентов в случайном порядке распределили по группам для получения ВМГК (n=16) и ГБОТ (n=20).
Через 6, 12 и 18 месяцев после лечения участники обеих групп достигли схожих показателей улучшения. Эти результаты подтверждают результаты нашего исследования. Таким образом, длительность ответа, наблюдаемого в нашей когорте через 4 недели после последней инстилляции, сохраняется в среднесрочной перспективе. Тем не менее, для определения того, как долго длится действие ВМГК, необходимо долгосрочное наблюдение за нашей когортой.
Shao et al. также пришли к выводу о более простом введении и хорошей переносимости интравезикальной ГК по сравнении с ГБОТ [10]. Действительно, несмотря на эффективность ГБОТ, этот метод лечения имеет несколько недостатков: пациенты проводят 90 минут 5–7 дней в неделю в гиперборической барокамере, вдыхая 100% кислород при давлении от 2 до 2,4 атмосферы; обычная длительность ГБОТ составляет 40 процедур в течение 8-недельного периода [5]; стоимость лечения довольно высока, при этом доступ к ГБОТ ограничен несколькими экспертными центрами.
Поэтому из-за значительных требований к ресурсам и опыту использование ГБОТ остается ограниченным. И наоборот, мы подтвердили, что интравезикальная инстилляция ВМГК является краткосрочным и легкодоступным вариантом лечения, который не требует специальной технической платформы. Для сравнения, степень влияния ВМГК на частоту мочеиспускания аналогична влиянию антимускариновых препаратов, которые в течение многих лет применяются для лечения пациентов с нейрогенной гиперактивностью детрузора [20], показывая многообещающие результаты.
Интравезикальное введение ГК также может оказывать профилактическое действие. В недавно опубликованном РКИ инстилляции гиалуроновой кислоты и хондроитинсульфата, проводимые во время лучевой терапии, обеспечили предотвращение развития симптомов со стороны мочевыводящих путей и улучшение качества жизни через 1 год наблюдения [21].
Была отмечена безопасность и хорошая переносимость интравезикальных инстилляций ВМГК. Были зарегистрированы только два незначительных НЯ (6%; 2/30). Эти осложнения представляли собой два случая гематурии, которые находились под наблюдением и разрешились спонтанно. Наши результаты указывают на превосходящую эффективность по сравнению с другими интравезикальными методами лечения радиационного цистита.
В недавнем исследовании оценивали интравезикальное применение солей алюминия (квасцов) у 40 пациентов с рефрактерным радиационным циститом [22]. По завершении периода наблюдения, медиана которого составила 17 месяцев, только 13 пациентов (32,5%) не нуждались в дополнительном лечении, что поставило под сомнение длительность эффекта этого метода. Кроме того, сообщалось о нескольких случаях токсичности алюминия при системной абсорбции у пациентов с почечной недостаточностью [23].
Подобным образом интравезикальное введение формалина, о котором впервые упоминается в 1973 году, при концентрации 10% ассоциируется с частыми серьезными побочными эффектами [24]. Хотя было установлено, что формалин эффективен для контроля гематурии, после лечения могут возникнуть серьезные осложнения, включая анурию, гидронефроз, фистулы и септическую смерть [25, 26]. Интравезикальная инстилляция ГК позволяет решить все эти проблемы, поскольку не вызывает серьезных НЯ.
Тем не менее, следует признать некоторые потенциальные ограничения этого пилотного исследования. Основные ограничения касаются включение только одной группы и небольшого числа набранных пациентов. Чтобы подтвердить на большей когорте эффективность ИНСТИЛАНА в лечении радиационного цистита, необходимо проведение дальнейших сравнительных исследований.
Длительность ответа, наблюдаемая через 4 недели после последней инстилляции, была обнадеживающей. В настоящее время продолжается годичное наблюдение за нашей когортой, чтобы определить, как долго длится действие ВМГК и необходимы ли повторные инстилляции. Наконец, полученные результаты оценивали с использованием визуальной аналоговой шкалы, которая в данном случае не является валидированным инструментом.
Заключение
Интравезикальные инстилляции ВМГК эффективны в лечении радиационного цистита. Для подтверждения наших предварительных результатов необходимое проведение дальнейших сравнительных исследований с более длительным периодом наблюдения.
Вклад авторов: Концепция и дизайн исследования: MF. Сбор данных: MF, CC, AC, J-PG, YB, YR, SD, CS. Анализ и интерпретация данных: MB, BG-T и MF. Подготовка рукописи: MB, MF и CS. Критический пересмотр рукописи на предмет важного интеллектуального содержания: MF и CS. Статистический анализ: BG-T.
Финансирование: Исследование было проведено при финансовой поддержке компании «ЛИДДЕ Терапевтикс САС».
Доступ к данным и материалам: Данные доступны по запросу соответствующему автору.
Наличие кодов: Отсутствует.
Заявления
Конфликт интересов: Авторы сообщают об отсутствии конфликта интересов.
Одобрение комитетом по вопросам этики: Протокол исследования и поправки были одобрены Комитетом по защите прав личности: CPP Sud-Est VI—Clermont Ferrand.
Согласие на участие: Все участники получили информацию в письменном виде и подписали согласие на участие.
Согласие на публикацию: Все авторы одобряют предоставление материалов.
Примечание издателя: Издательство «Шпрингер Нейче» (Springer Nature) сохраняет нейтральную позицию в отношении юридических претензий в опубликованных картах и принадлежности к определенным учреждениям.
Оригинал статьи: https://doi.org/10.1007/s00345-021-03837-9
Michael Baboudjian1 · Marc Fourmarier2 · Christophe Clement3 · Arnaud Cherasse4 · Jean‑Pierre Graziana5 · Youssef Bentaleb6 · Yohann Rouscoff7 · Sylvain Ducrocq8 · Bastien Gondran‑Tellier1 · Christian Saussine9
- Отделение урологии и трансплантации почки, больница La Conception, Университет Экс-Марсель, APHM, Марсель, Франция
- Отделение урологии, больница CH Aix-Pertuis, Экс-ан-Прованс, Франция
- Отделение урологии, клиника Рон Дюранс, Авиньон, Франция
- Отделение урологии, клиника Валь д’Уэст, Экюли, Франция
- Отделение урологии, клиника Mutualiste de la Porte de L’Orient, Лорьян, Франция
- Отделение урологии, больница CH Jean Rougier, Каор, Франция
- Отделение урологии, клиника Сен-Жорж, Ницца, Франция
- Отделение урологии, больница CH Notre Dame de la Miséricorde, Аяччо, Франция
- Отделение урологии, NHC, Университетская клиника Страсбурга, Страсбург, Франция
Литература:
- Matz EL, Hsieh MH (2017) Review of advances in uroprotective agents for cyclophosphamide- and ifosfamide-induced hemorrhagic cystitis. Urology 100:16–19
- Payne H, Adamson A, Bahl A et al (2013) Chemical- and radiation-induced haemorrhagic cystitis: current treatments and challenges. BJU Int 112:885
- Fransson P, Widmark A (1999) Late side effects unchanged 4–8 years after radiotherapy for prostate carcinoma: a comparison with age-matched controls. Cancer 85:678–688
- Mendenhall WM, Henderson RH, Costa JA et al (2015) Hemorrhagic radiation cystitis. Am J Clin Oncol 38(3):331–336
- Ribeiro de Oliveira TM, Carmelo Romao AJ, Gamito Guerreiro FM, Matos Lopes TM (2015) Hyperbaric oxygen therapy for refractory radiation-induced hemorrhagic cystitis. Int J Urol 22:962–966
- Oscarsson N, Müller B, Rosén A et al (2019) Radiation- induced cystitis treated with hyperbaric oxygen therapy (RICH- ART): a randomised, controlled, phase 2–3 trial. Lancet Oncol 20(11):1602–1614
- Zwaans BM, Chancellor MB, Lamb LE (2016) Modeling and treatment of radiation cystitis. Urology 88:14–21
- Browne CD, Davis NF, Mac Craith E et al (2015) A narrative review on the pathophysiology and management for radiation cystitis. Adv Urol 2015:346812
- Pascoe C, Duncan C, Lamb BW et al (2019) Current management of radiation cystitis: a review and practical guide to clinical management. BJU Int 123(4):585–594
- Shao Y, Lu GL, Shen ZJ (2012) Comparison of intravesical hyaluronic acid instillation and hyperbaric oxygen in the treatment of radiationinduced hemorrhagic cystitis. BJU Int 109(5):691–694
- Lazzeri ML, Hurle R, Casale P et al (2016) Managing chronic bladder diseases with the administration of exogenous glycosaminoglycans: an update on the evidence. Ther Adv Urol 8:91–99
- Wyndaele JJJ, Riedl C, Taneja R, Lovász S, Ueda T, Cervigni M (2019) GAG replenishment therapy for bladder pain syndrome/ interstitial cystitis. Neurourol Urodyn 38(2):535–544
- Morales A, Emerson L, Nickel JC (1997) Intravesical hyaluronic acid in the treatment of refractory interstitial cystitis. Urology 49:111–113
- Shao Y, Shen ZJ, Rui WB, Zhou WL (2010) Intravesical instillation of hyaluronic acid prolonged the effect of bladder hydrodistention in patients with severe interstitial cystitis. Urology 75:547–550
- Ahmad I, Sarath Krishna N, Meddings RN (2008) Sequential hydrodistension and intravesical instillation of hyaluronic acid und er general anaesthesia for treatment of refractory interstitial cystitis: a pilot study. Int Urogynecol J Pelvic Floor Dysfunct 19(4):543–546
- Sommariva ML, Sandri SD, Ceriani V (2010) Efficacy of sodium hyaluronate in the management of chemical and radiation cystitis. Minerva Urol Nefrol 62(2):145–150
- Miodosky M, Abdul-Hai A, Tsirigotis P et al (2006) Treatment of post-hematopoietic stem cell transplantation hemorrhagic cystitis with intravesicular sodium hyaluronate. Bone Marrow Transplant 38(7):507–511
- Constantinides C, Manousakas T, Nikolopoulos P, Stanitsas A, Haritopoulos K, Giannopoulos A (2004) Prevention of recurrent bacterial cystitis by intravesical administration of hyaluronic acid: a pilot study. BJU Int 93(9):1262–1266
- Cardinal J, Slade A, McFarland M et al (2018) Scoping review and meta-analysis of hyperbaric oxygen therapy for radiation-induced hemorrhagic cystitis. Curr Urol Rep 19:38
- Madhuvrata P, Singh M, Hasafa Z, Abdel-Fattah M (2012) Anticholinergic drugs for adult neurogenic detrusor overactivity: a systematic review and meta-analysis. Eur Urol 62(5):816–830
- Redorta JP, Sanguedolce F, Pardo GS et al (2021) Multicentre international study for the prevention with iAluRil of radioinduced cystitis (MISTIC): a randomised controlled study. Eur Urol Open Sci 23(26):45–54
- Westerman ME, Boorjian SA, Linder BJ (2016) Safety and efficacy of intravesical alum for intractable hemorrhagic cystitis: a contemporary evaluation. Int Braz J Urol 42:1144–1149
- Phelps KR, Naylor K, Brien TP et al (1999) Encephalopathy after bladder irrigation with alum: case report and literature review. Am J Med Sci 318:181–185
- Shah BC, Albert DJ (1973) Intravesical instillation of formalin for the management of intractable hematuria. J Urol 110:519–520
- Lojanapiwat B, Sripralakrit S, Soonthornphan S (2002) Intravesicle formalin instillation with a modified technique for controlling haemorrhage secondary to radiation cystitis. Asian J Surg 25:232–235
- Dewan AK, Mohan GM, Ravi R (1993) Intravesical formalin for hemorrhagic cystitis following irradiation of cancer of the cervix. Int J Gynaecol Obstet 42:131–135