Астенічний синдром у постковідного пацієнта (огляд публікацій та власний досвід)
Резюме. Серед симптомів та синдромів, які домінують у клінічній картині постковідного синдрому (POST-COVID-19), на перший план виходять ознаки астенізації, підвищеної втомлюваності, надмірного виснаження при звичайній щоденній діяльності, що формують астенічний синдром. Для лікування постковідного астенічного синдрому запропоновано комбінацію патогенетично обґрунтованих засобів: едаравон (ксаврон), суміш L-аргініну та L-карнітину (тіворель) та розчин ксилітолу (ксилат). Заплановану програму інфузій отримали 12 пацієнтів, загальна тривалість лікування становила 14 днів.
Результати: вже на 7-й день лікування спостерігалася достовірне зменшення вираженості слабкості (з 7,2±1,1 до 4,9±0,9 бали, p<0,05) та стомлюваності пацієнтів (з 8,1±1,2 до 6,4±0,8 бали, p<0,05). По закінченні лікування ці зміни стали яскраво вираженими і високодостовірними (p<0,01). Відзначено також покращення працездатності, зменшення вираженості відчуття «розбитості» (відповідно з 4,2±0,6 до 3,6±0,7 та з 5,1±0,7 до 4,0±0,9 бали; p<0,05) та покращення здатності до концентрації і уваги (з 4,9±0,9 бали до початку лікування до 3,4±0,6 бали по закінченні курсу лікування, p<0,05). Усі хворі задовільно перенесли програму інфузій, ускладнень та побічних ефектів при проведенні інфузійної терапії не спостерігалося.
Ключові слова: COVID-19, постковідний синдром, астенічний синдром, ксаврон, тіворель, ксилат.
У лютому 2020 року на основі попередніх даних, ВООЗ повідомила, що час від початку до клінічного одужання для легких випадків становить приблизно 2 тижні, для пацієнтів з тяжким або критичним захворюванням одужання займає від 3 до 6 тижнів [1]. Але згодом з’ясувалося, що у деяких хворих окремі симптоми зберігалися протягом тижнів або навіть місяців, а в окремих пацієнтів симптоми ніколи не зникали.
Одужання затягувалося через можливі причини:
- • стійку віремію через слабку або відсутню відповідь антитіл,
- • рецидив або повторне інфікування,
- • запальні та інші імунні реакції,
- • психічні фактори, такі як посттравматичний стрес [2].
Подібні довгострокові респіраторні, скелетно-м’язові і нейро-психіатричні наслідки були описані для інших коронавірусів (SARS і MERS), і вони мають пато-фізіологічні паралелі з пост-COVID-19 [2].
Таким чином, поступово стали формуватися дві групи людей, які постраждали від коронавірусу: 1) ті, хто мали незворотні ушкодження легенів, серця, нирок або мозку, які негативно вплинули на їх здатність функціонувати; 2) ті, хто продовжував відчувати виснажливі симптоми, незважаючи на відсутність помітних ушкоджень органів [3].
За даними інфекційного центру в лікарні принцеси Маргарет у Гонконзі, після виписки зі стаціонару у 19% пацієнтів виявлено ознаки ушкодження серця, 25% пацієнтів страждали від задишки, у 20% були ознаки зниження функції легень. У багатьох хворих спостерігалися також довготривалі наслідки у діяльності центральної нервової системи: зниження уваги, концентрації і пам’яті; дисфункція периферичних нервів; швидка втомлюваність, слабкість [4].
У США пацієнти, які відчували тривалі симптоми вже після одужання від COVID-19, організувалися в групу «POST-COVID- далекобійників», назва яких стала популярною і розповсюдилася світом серед пацієнтів, що перенесли COVID-19.
POST-COVID long hauler (далекобійник[1]) – будь-яка людина, у якої діагностовано коронавірус, що викликає COVID-19, але яка не повернулась до свого рівня здоров’я та функціонування через шість місяців після перенесеного захворювання [3].
Таким чином, сьогодні виділяють наступні періоди перебігу COVID-19:
- • Гостра респіраторна інфекція COVID-19 (Acute COVID-19 infection) – симптоми тривають до 4 тижнів.
- • Триваючий симптоматичний COVID-19 (Ongoing symptomatic COVID-19) – симптоми COVID-19 зберігаються від 4 до 12 тижнів.
- • Постковідний синдром (POST-COVID-19).
Триваючий симптомний COVID-19 і Постковідний синдром часто об`єднують в поняття Long COVID [5].
У грудні 2020 року оприлюднено Керівництво NICE з управління довгостроковими наслідками COVID-19, в якому дається наступне визначення постковідного синдрому:
Постковідний синдром (POST-COVID-19) – комплекс ознак та симптомів, що розвиваються під час або після інфекції COVID-19, тривають більше 12 тижнів і не пояснюються альтернативним діагнозом [6].
Які фактори ризику виникнення постковідного синдрому? Або іншими словами – хто з більшою ймовірністю стане постковідним довготягом (далекобійником)? Виявилося, що тривалі симптоми частіше виникають у:
- • людей старше 50 років,
- • хворих із двома чи трьома хронічними захворюваннями,
- • хворих, які мали тяжкий перебіг COVID-19 [7].
Проте виявилося, що хворі, які слабо постраждали від COVID-19, також можуть мати затяжні симптоми, а пацієнти, які були тяжко хворими, можуть повернутися до нормального стану вже через два місяці [7].
Серед симптомів та синдромів, які домінують у клінічній картині постковідного синдрому, на перший план висуваються ознаки астенізації, підвищеної втомлюваності, надмірного виснаження при звичайній щоденній діяльності. У пацієнтів, які перенесли гострий період COVID-19, усі ці ознаки формують астенічний синдром.
Астенічний синдром (від грец. Ἀσθένεια – безсилля) – хворобливий стан, що виявляється підвищеною стомлюваністю з крайньою нестійкістю настрою, ослабленням самовладання, нетерплячістю, непосидючістю, порушенням сну, втратою здатності до тривалого розумового і фізичного напруження, непереносимістю гучних звуків, яскравого світла, різких запахів.
Астенічний синдром – це комплекс ознак, які проявляються:
- • зниженням фізичної активності (зниження витривалості і працездатності, швидко наступає втома, постійне відчуття «розбитості»),
- • погіршенням інтелектуальних функцій (зниження концентрації уваги, труднощі в засвоєнні нової інформації, порушення пам’яті, уповільнення швидкості прийняття рішення),
- • психологічними розладами (дратівливість, внутрішня напруженість, нестійкий настрій, зниження мотивації до роботи і творчості, боязнь майбутніх труднощів, втрата інтересу до життя) [8].
Можливі причини астенії при постковідному синдромі:
- • Тривалий і виснажуючий перебіг захворювання з дихальною недостатністю і водно-електролітними розладами,
- • Масивне медикаментозне навантаження під час терапії COVID-19 (дексаметазон),
- • Порушення режиму і повноцінності харчування,
- • Неадекватне лікування цукрового діабету та інших нейро-ендокринних захворювань,
- • Супутні тяжкі і / або декомпенсовані системні захворювання з порушенням свідомості та мобільності пацієнта (здатності до самообслуговування).
Крім того, відомо, що масивна вірусна інвазія призводить до прямого ураження ендотеліоцитів вірусом або їх опосередкованого пошкодження імунними клітинами, цитокінами та вільними радикалами. Розвивається виражена ендотеліальна дисфункція, яка в поєднанні з хронічним запаленням супроводжуються гіперкоагуляцією, підвищенням рівня фібриногену, зниженням процесів фібринолізу й антикоагуляції, що, своєю чергою, зумовлює тромбоутворення [9]. Ураження ендотелію судин унаслідок гіперімунної реакції (ушкодження цитокінами та вільними радикалами) спричиняє розвиток системного фонового «тліючого» запалення в постковідний період [10].
Зазначені фактори призводять до порушень утилізації глюкози, розвитку енергетичної недостатності та формування астенічного синдрому. В свою чергу, астенічний синдром призводить до подальшого обмеження можливостей доставки в клітини достатньої кількості глюкози і поглиблює енергетичну недостатність. Так формується «зачароване коло» замкнених патологічних процесів (див. рисунок).
[1] Варіанти перекладу слів «long hauler» (рос. – «дальнобойщик»): довготяг, довговантажник, далековоз.
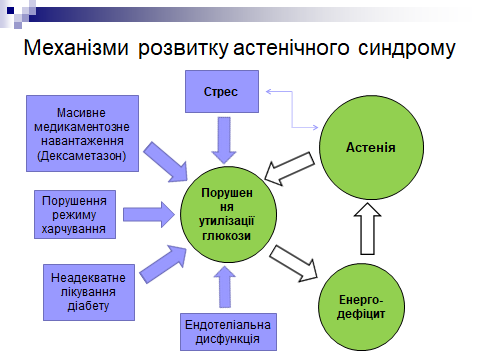
Рис.1. Механізми формування астенічного синдрому у post-COVID періоді
На думку знаних вітчизняних фахівців, наявність зазначених механізмів обґрунтовує необхідність застосування лікувальних методів для стабілізації ендотелію, покращення утилізації глюкози і зниження внутрішньоклітинного енергодефіциту [9, 11].
| Основні напрямки лікування при постковідному астенічному синдромі:
1. Оптимізація медикаментозного лікування і раннє скасування препаратів з катаболічними ефектами (дексаметазон). 2. Організація оптимального за кількістю і збалансованого за складом харчування, психологічна підтримка в родині і на роботі. 3. Виявлення і контроль водно-електролітних і метаболічних порушень при супутніх захворюваннях (цукровий діабет, артеріальна гіпертензія). 4. Профілактика розвитку метаболічних розладів (кетоацидозу голодування і ДКА). 5. Покриття внутрішньоклітинного енергодефіциту. 6. Корекція ендотеліальної дисфункції. 7. Ліквідація «тліючого» системного запалення. |
Допоки не розроблена вакцина від COVID‑19, пріоритетною задачею клініцистів є зниження ризику фатальних ускладнень. Із цією метою може застосовуватися патогенетичне лікування, проте варто зауважити, що всі препарати патогенетичної дії застосовуються off-label, тобто поза межами показань відповідно до офіційних інструкцій [12]. Так, едаравон (Ксаврон®, «Юрія-Фарм», Україна) являє собою низькомолекулярний антиоксидантний засіб, який має протизапальну дію за рахунок пригнічення цитокінового шторму (зменшення продукції фактора некрозу пухлини, IL-1, IL‑6 [13]), а також чинить інгібуючий вплив на проникність ендотеліоцитів мікроциркулярного русла легень [14]. Едаравон швидко нейтралізує вільні радикали; гальмує перекисне окиснення ліпідів, захищаючи клітини від руйнування; активує ферменти антиоксидантного захисту (супероксиддисмутазу, каталазу, глутатіонпероксидазу)[15]. Ці властивості роблять доцільним застосування едаравону при гострому респіраторному дистрес-синдромі (ГРДС). Зокрема, у рекомендаціях Японських товариств із застосування респіраторної підтримки та інтенсивної терапії рекомендується едаравон як препарат, який доцільно застосовувати для лікування пацієнтів із ГРДС у відділеннях інтенсивного лікування [16].
Іншими діючими речовинами, вплив яких при COVID‑19 активно вивчається, є L‑аргінін і L‑карнітин. Ці речовини є складниками вітчизняного препарату Тіворель® («Юрія-Фарм»). L‑аргінін покращує мікроциркуляцію, забезпечуючи стійку вазодилатацію, зміцнює імунну систему й активує Т‑клітинний імунітет, чинить мембраностабілізуючу, цитопротекторну й антиоксидантну дії, збільшує вміст оксиду азоту (NO) в легеневій тканині, зменшуючи спазм бронхів і легеневих артерій [17]. Зниження продукції NO в результаті його посиленого руйнування під дією вільних радикалів і зменшення доступності попередника NO (L-аргініну) призводить до переваги дії вазоконстрикторів і посилення адгезії тромбоцитів. Тому екзогенне надходження L-аргініну як субстрату для синтезу NO патогенетично обґрунтовано для зменшення проявів ендотеліальної дисфункції і в постковідний період [18].
Своєю чергою, L‑карнітин сприяє отриманню енергії з жирних кислот, чинить імуномодулювальну дію, пригнічуючи вивільнення прозапальних цитокінів, виступає прямим антиоксидантом, запобігає апоптозу клітин, є відомим кардіопротектором. За рахунок аргініну препарат Тіворель виступає донатором NO, основна функція котрого пов’язана з вазодилатацією та гальмуванням процесів агрегації й адгезії тромбоцитів. Цей препарат інгібує здатність коронавірусів прикріплятися до клітин, протидіє реплікації вірусів, сприяє зменшенню ендотеліальної дисфункції [12].
І, нарешті, для покриття внутрішньоклітинного енергодефіциту та профілактики розвитку метаболічних розладів (кетоацидозу голодування і діабетичного кетоацидозу) можуть ефективно використовуватися препарати на основі ксилітолу, наприклад, Ксилат® («Юрія-Фарм», Україна). Таке припущення базується на наступних аргументах. Ксилітол є незалежним від інсуліну джерелом енергії. Підвищуючи інтенсивність гліколізу, ксиліт посилює утворення піровиноградної кислоти, яка сприяє окисленню ацетил-коензиму А в циклі Кребса. Як наслідок – ксилітол стабілізує енергетичні процеси всередині клітин і підвищує енергетичну ефективність метаболізму, нормалізує водно-електролітний баланс, проявляє виражену антикетогенну дію [19].
Таким чином, ретельний аналіз наявних літературних джерел дає підстави рекомендувати наступну комбінацію патогенетично обґрунтованих засобів для лікування постковідного синдрому: ксаврон (ліквідація «тліючого» системного запалення), тіворель (зменшення проявів ендотеліальної дисфункції і кардіопротекція) та ксилат (покриття внутрішньоклітинного енергодефіциту та профілактика метаболічних розладів). Для перевірки ефективності цієї комбінації було проведено спеціальне пілотне дослідження.
Власний досвід
Метою дослідження було визначити можливість застосування патогенетично-обґрунтованої комбінації препаратів ксаврон, тіворель та ксилат у хворих на виражений астенічний постковідний синдром.
Протягом грудня 2020 року – лютого 2021 року для проведення дослідження було залучено 14 пацієнтів, які звернулися до сімейного лікаря зі скаргами на виражений астенічний синдром, що розвинувся після перенесеного COVID-19. З кожним хворим була проведена персональна бесіда з роз’ясненням можливих методів лікування, запропонованої програми та можливими побічними ефектами. З 14 пацієнтів 2 відмовилися від участі у дослідженні. Після підписання Інформаційної Згоди, заплановану програму інфузій отримали 12 пацієнтів. Жоден з хворих не припинив вже розпочатої програми інфузій, загальна тривалість лікування становила 14 днів.
Слід зазначити, що на сьогоднішній день немає розроблених тестів чи опитувальників, які б дозволяли оцінити вираженість постковідного астенічного синдрому. Тому для контролю ефективності лікування ми розробили власний опитувальник, який враховував наявність найбільш поширених симптомів астенічного синдрому, а саме: слабкість, швидку втомлюваність, зниження витривалості і працездатності, постійне відчуття «розбитості», зниження концентрації та уваги, труднощі в засвоєнні нової інформації, порушення пам’яті, уповільнення швидкості прийняття рішень, дратівливість, внутрішня напруженість, нестійкий настрій, зниження мотивації до роботи і творчості, боязнь майбутніх труднощів, втрата інтересу до життя. Цей опитувальник хворі заповнювали тричі: перед початком лікування, після першого тижня лікування і після отримання останньої інфузії.
Схема внутрішньовенних інфузій включала: Ксаврон – по 30 мг два рази на день (препарат розводили в 100 мл 0,9% розчину NaCl і вводили протягом 30 хв зі швидкістю 40 крапель/хв), TIVOR-L® – по 100 мл 1р./день (30 крап./хв), Ксилат – по 200 мл (5-6 мл/кг) 1р./день протягом 60 хв (швидкість 40 крап./хв.). Лікування починали у понеділок. Інфузії зазначених препаратів проводили протягом 5 днів, потім робили перерву на 2 дні, проводили проміжне анкетування, потім – повторно 5 днів інфузій, перерва 2 дні і повторне обстеження і анкетування.
Результати проведеного лікування представлені у таблиці 1.
Таблиця 1
Динаміка симптомів постковідного астенічного синдрому, бали (M±SD)
| Комплекси ознак | Симптоми | Етапи лікування | ||
| До інфузії | 7-й день | 14-й день | ||
| Фізична активність | Слабкість | 7,2±1,1 | 4,9±0,9* | 3,1±0,8** |
| Швидка втомлюваність | 8,1±1,2 | 6,4±0,8* | 5,2±0,9** | |
| Зниження працездатності | 4,2±0,6 | 3,9±0,7 | 3,6±0,7* | |
| Відчуття «розбитості» | 5,1±0,7 | 4,8±0,8 | 4,0±0,9* | |
| Інтелектуальні функції | Зниження концентрації і уваги | 4,9±0,9 | 4,6±0,8 | 3,4±0,6* |
| Труднощі в засвоєнні нової інформації | 2,6±0,1 | 2,5±0,6 | 2,4±0,7 | |
| Уповільнення швидкості прийняття рішення | 3,0±0,2 | 2,9±0,5 | 2,9±0,5 | |
| Розлади пам’яті | 2,7±0,4 | 2,6±0,2 | 2,5±0,3 | |
| Психологічні розлади | Дратівливість | 4,9±2,1 | 4,8±1,8 | 4,8±1,0 |
| Нестійкий настрій | 6,5±2,6 | 5,9±1,7 | 5,8±1,2 | |
| Зниження мотивації до роботи і творчості | 5,4±1,7 | 5,3±1,2 | 5,2±0,9 | |
| Втрата інтересу до життя | 4,9±1,9 | 4,4±1,5 | 4,3±1,2 | |
Примітка. * – різниця з етапом до інфузії достовірна (p<0,05)
**- різниця з етапом до інфузії достовірна (p<0,01)
Аналіз представлених у табл.1 даних показав, що вже на 7-й день лікування спостерігалася достовірне зменшення вираженості слабкості (з 7,2±1,1 до 4,9±0,9 бали, p<0,05) та стомлюваності пацієнтів (з 8,1±1,2 до 6,4±0,8 бали, p<0,05). По закінченні лікування ці зміни стали яскраво вираженими і високодостовірними (p<0,01). Наприкінці дослідження відзначено також покращення працездатності та зменшення вираженості відчуття «розбитості» (відповідно з 4,2±0,6 до 3,6±0,7 та з 5,1±0,7 до 4,0±0,9 бали; p<0,05). Усі перераховані зміни відображають покращення фізичного стану пацієнтів та фізичної працездатності.
З блоку питань, що характеризували інтелектуальні функції, зміни спостерігалися лише в зменшенні такого симптому, як «Зниження концентрації і уваги» (з 4,9±0,9 бали до початку лікування до 3,4±0,6 бали по закінченні курсу інфузій, p<0,05).
Щодо блоку симптомів, що характеризують психологічні розлади, то незважаючи на зниження загальних оцінок, достовірної різниці не спостерігалося, що свідчить про необхідність введення в програму постковідної реабілітації допомогу психолога та/або психотерапевта.
Принагідно відзначимо, що у жодного хворого не спостерігалося посилення симптомів по жодному з блоків опитування. Усі хворі задовільно перенесли програму інфузій. Ускладнень та побічних ефектів при проведенні інфузійної терапії не спостерігалося.
Висновки:
- Астенічний синдром є частим ускладненням перебігу гострого COVID-19, який потребує уваги та лікування. Для терапії вираженого астенічного синдрому може застосовуватися схема інфузійної терапії у складі препаратів ксаврону, ксилату та тиворелю.
- Найкращі результати лікування відзначалися з боку симптомів, що характеризують фізичну активність пацієнтів, зокрема значне покращення фізичних кондицій спостерігалося вже на 7-й день лікування. Меншою мірою покращилися показники психологічних змін, що демонструє необхідність залучення психолога та/або психотерапевта до команди реабілітації постковідних пацієнтів.
- Запропонована схема добре переносилася хворими, ускладнень та побічних ефектів при проведенні інфузійної терапії не спостерігалося.
Література:
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19). Geneva, WHO. 16-24 February, 2020. www.who.int/docs/default-source/coronavirus
- www.msdmanuals.com/professional/news/editorial/2020/09/23/20/17/post-covid-syndrome
- www.health.harvard.edu/blog/the-tragedy-of-the-post-covid-long-haulers-2020101521173
- www.jamanetwork.com/journals/ jamacardiology/fullarticle/2763524
- www.england.nhs.uk/coronavirus/wp-content/uploads/sites/52/2020/10/C0840_pdf
- COVID-19 rapid guideline: managing the long-term effects of COVID-19. NICE guideline/ Published: 18 December 2020/ www.nice.org.uk/guidance/ng188
- Couzin-Frankel J. The long haul. Science. 2020 Aug 7;369(6504):614-617. doi: 10.1126/science.369.6504.614.
- Астенические расстройства в терапевтической практике. Руководство по диагностике и лечению. Под редакцией А.В. Шаброва, С.Л. Соловьевой. СПб, 2010, 380 с.
- Голубовська О.А. Постковідний синдром: патогенез та основні напрями реабілітації. Медична газета «Здоров’я України 21 сторіччя» №2 (495), 2021: 16-18.
- Varga Z., Flammer A.J., Steiger P. et al. Endothelial cell infection and endotheliitis in COVID-19. The Lancet. 2020; 395 (2): 1417-1418.
- Коваленко С.В. Досвід застосування методів синдромно-патогенетичної терапії при пневмонії, спричиненій COVID-19, в умовах пульмонологічного відділення. Медична газета «Здоров’я України 21 сторіччя» № 13-14 (481-482), 2020 р.
- Потенційні можливості лікування COVID-19: протидія надмірному запаленню, антиоксидантний вплив і цитопротекція. Медична газета «Здоров’я України 21 сторіччя», 2020, № 20 (489): 38-40.
- Reznik SE, Tiwari AK, Ashby CR Jr. Edaravone: A potential treatment for the COVID-19-induced inflammatory syndrome? Pharmacol Res. 2020 Oct;160:105055. doi: 10.1016/j.phrs.2020.105055.
- Saito Y, Fujii Y, Yashiro M, et al. Inhibitory Effects of Edaravone, a Free Radical Scavenger, on Cytokine-induced Hyperpermeability of Human Pulmonary Microvascular Endothelial Cells:A Comparison with Dexamethasone and Nitric Oxide Synthase Inhibitor. Acta Med Okayama. 2015;69(5):279-90. doi: 10.18926/AMO/53674.
- Watanabe K, Tanaka M, Yuki S, Hirai M, Yamamoto Y. How is edaravone effective against acute ischemic stroke and amyotrophic lateral sclerosis? J Clin Biochem Nutr. 2018 Jan;62(1):20-38. doi: 10.3164/jcbn.17-62.
- Hashimoto S., Sanui M., Egi M. et al. The clinical practice guideline for the management of ARDS in Japan. Journal of Intensive Care. 2017; 5: 50. doi: 10.1186/s40560-017-0222-3.
- Поліщук М.Є., Галушко О.А., Гуменюк М.І., Тріщинська М.А. Інфузійна терапія в неврології і нейрохірургії. К.: Книга-плюс, 2020. 304 с.
- Zhang W, Zhao Y, Zhang F, et al. The use of anti-inflammatory drugs in the treatment of people with severe coronavirus disease 2019 (COVID-19): The Perspectives of clinical immunologists from China. Clin Immunol. 2020 May;214:108393. doi: 10.1016/j.clim.2020.108393.
- Галушко О.А. Особливості виникнення та перебігу електролітних порушень в гострий період інсульту у хворих на цукровий діабет. Медицина неотложных состояний, 2017, №1(80): 87-92.