Антимікробна терапія важких “цивільних” інтраабдомінальних інфекцій: сучасний підхід до емпіричної антибіотикотерапії
Резюме. В цій публікації обговорюються проблеми лікування важких інтраабдомінальних інфекцій, а саме емпірична антимікробна терапія вторинних перитонітів з огляду на сучасний стан питання в розумінні авторів, сучасних настанов та наказів МОЗ України.
Місця використання добре відомого, але нового для України препарату піперацилін/тазобактаму, карбапенемів, антибіотиків резерву.
Ми не розглядаємо тут кандидозний, первинний та третинний перитоніти, сподіваємось цьому приділити увагу у наступних публікаціях.
Ключові слова: інтраабдомінальні інфекції, інтенсивна терапія, емпірична антибіотикотерапія, піперацилін/тазобактам.
Актуальність
Інтраабдомінальні інфекції (ІАІ) – це поняття, що об’єднує велику кількість патологічних станів, більшість з яких виникають внаслідок потрапляння мікроорганізмів із шлунково-кишкового тракту (ШКТ) у стерильні ділянки черевної порожнини. Це може статися у разі ушкодження стінки ШКТ внаслідок перфорації (апендицит, перфоративна виразка або дивертикуліт), травми або хірургічного втручання. Товариство інфекційних хвороб США (IDSA) пропонує класифікувати ІАІ таким чином:
- Позашпитальні та шпитальні;
- Пізні шпитальні (зазвичай третинні перитоніти);
- Неускладнені та ускладнені (коли до патологічного процесу залучені більш ніж один орган черевної порожнини, або один орган та очеревина). Пізній початок госпітальний
- З порушенням анатомічного бар’єру (перфорації, проникаючи травми);
- Без порушення анатомічного бар’єру (панкреатит, холецистіт);
- З локалізованим перитонітом
- З розлитим перитонітом
А пацієнтів розділяти на групи середнього та високого ризику щодо недосягнення контролю джерела інфекції, низький ризик відсутній при діагнозі ІАІ. До пацієнтів високого ризику відносять:
- ті кому виконане оперативне втручання спрямоване на контроль джерела інфекції пізніше 24 годин;
- оцінювання за APACHE ІІ ≥ 15 балів;
- похилий вік;
- декомпенсація супутніх захворювань;
- низький рівень альбуміну;
- знижений аліментарний статус;
- дифузний перитоніт;
- наявність злоякісних новоутворень.
Опис пацієнтів групи високого ризику дуже часто співпадає із «середньостатистичним» пацієнтом ВАІТ. В подальшому і цій статті мова буде йти про ускладнену ІАІ, тобто вторинний перитоніт.
Проблема лікування інтраабдомінальних інфекцій існує дуже давно, але не дивлячись на вивченість й досі лишається однією з основних причин смертності у відділеннях анестезіології та інтенсивної терапії (ВАІТ), та зберігає друге місце ( 18%) серед інфекцій ВАІТ за даними EPIC III, при чому хоча б один антибіотик отримувало 68% пацієнтів ВАІТ.
[1] ІАІ частіше асоціюються із септичним шоком і гострим ураженням нирок, ніж інфекції інших локалізацій. [2] Багатоцентрові дані про клінічні ознаки та мікробіологію абдомінальних інфекцій у важкохворих є рідкісними та часто обмежені одним регіоном чи країною. В останні роки повідомляють про збільшення абдомінальних інфекцій, спричинених нозокоміальними та резистентними мікроорганізмами.
Нещодавні спостереження показали, що резистентність до антимікробних препаратів однаково часто зустрічається у позалікарняних і пізніх внутрішньолікарняних інфекціях, що ставить під сумнів основні принципи емпіричної протимікробної терапії, включаючи парадигму: патогени, залучені до позалікарняної інфекції, охоплюються стандартними емпіричними антимікробними схемами, а по-друге, концепції нозокоміального придбання, як основного фактора залучення резистентності. [5].
Так у Канаді повідомляють про неефективність емпіричної антибіотикотерапії у 9% пацієнтів з ускладненою ІАІ та 11% у пацієнтів з інфекцією сечостатевого тракту. [3].
Головним в лікуванні ускладненої ІАІ є своєчасний, ефективний та надійний хірургічний контроль джерела інфекції. Але ж і своєчасна та відповідна патоген спрямована терапія має важливе значення для ефективного лікування важких інфекцій, особливо в умовах невідкладної допомоги, і на початку вона звичайно емпірична. Процес прийняття рішень, який використовують клініцисти для досягнення цієї мети, далеко не простий, ми повинні вибрати один або кілька протимікробних препаратів для введення на ранніх стадіях захворювання завжди без знання збудника або, в кращому випадку, спираючись на попередні посіви, а в самому кращому ми маємо мікробіологічний паспорт власного відділення (що на теперішній момент рідкість).
В Україні цей вибір ускладнюється війною внаслідок агресії російської федерації, великою кількістю поранених, швидким розповсюдженням та селекцією надагресивних та надстійких мікроорганізмів. Саме тому ми додали слово «цивільних» у назву статті, звичайно ІАІ, що виникли внаслідок комботравми мають свої особливості патогенезу та лікування.
Методи та матеріали: аналіз наукометричних баз даних, власний досвід.
Результати
Щодо епідеміології ІАІ: одне з останніх когортних багато центрових досліджень має такі результати. До когорти увійшов 2621 пацієнт із 309 ВАІТ, країн північної та південної Америк, східної та західної Європи, країн Азії та Африки в рамках роботи групи “AbSeS”. Інфекція була позалікарняною у 31,6%, госпітальною з раннім початком у 25%, а лікарняною з пізнім початком у 43,4% пацієнтів. Загальна поширеність резистентності до антимікробних препаратів становила 26,3%, а грамнегативних бактерій, які важко піддаються лікуванню, – 4,3%, із великими варіаціями залежно від географічного регіону. Не спостерігалося жодної різниці в поширеності антимікробної резистентності залежно від шпитального чи поза шпитального інфікування.
Загальна смертність склала 29,1%. Незалежні фактори ризику смертності включали внутрішньолікарняну інфекцію з пізнім початком, розлитий перитоніт, сепсис, септичний шок, літній вік, недоїдання, печінкову недостатність, застійну серцеву недостатність, антимікробну резистентність (метицилінрезистентний Staphylococcus aureus, ванкоміцинрезистентний ентерокок, грамнегативні бактерії, що продукують бета-лактамази розширеного спектру, або стійкі до карбапенемів грамнегативні бактерії) і невдача контролю над джерелом інфекції. [6]. Наразі в Україні відсутня така інформація.
Як правило, ІАІ є полімікробною за участю грамнегативної флори, яка обумовлює системну протизапальну відповідь та анаеробів, які відіграють важливу роль у формуванні абсцесів, так звана двостадійна концепція захворювання. Основними аеробними збудниками ускладненої ІАІ за даними Європейського аналізу є Escherichia coli, Klebsiella pneumoniae, Enterococcus faecalis, Enterococcus faecium, та Pseudomonas aeruginosa. [7].
E. coli резистентність до фторхінолонів є значною вище в Центральній Європі, Східній та Південно-Східній Європі, та Південна Європа (27,7%, 20,9%, 23,1% відповідно) порівняно із Західною Європою (12,5%). Резистентність до карбапенемів є проблемою лише у Східній та Південно-Східній Європі (15,9%), а стійкість до аміноглікозидів є актуальною у країнах Центральної Європи (14,0%). K. pneumoniae показники резистентності до всіх відповідних антибіотиків були вищими в Центральній Європі, Східній і Південно-Східній Європі та Південній Європа порівняно із Західною. Резистентність P. aeruginosa є проблемою у всіх європейські регіонах. Стійкість до всіх класів антибіотиків часто перевищують 20% у західній Європі .
Надзвичайно високі показники резистентності спостерігаються у Південній Європі проти піперациліну/тазобактаму (37,5%), карбапенемів (38,3%), а у Східній та Південно-Східній Європі проти фторхінолонів (35,5%), аміноглікозидів (38,5%) та карбапенемів (45,0%). Зауважимо, також у західній Європі резистентність P. aeruginosa до карбапенему наближається до 30%.Стійкість до амінопеніциліну у E. fecalis є особливою проблемою на Сході та Південному-Сході Європи (30,6%), тоді як ванкоміцин резистентні ентерококи (VRE) загалом викликають менше занепокоєння. У штамів E. faecium резистентність до амінопеніциліну високий у всіх європейських регіонах (> 70%). Поширеність VRE виявляється вищим у центральній (15,4%) і східній, Південно-Східній Європі (15,2%), але кількість ізолятів низька [5].
Головним чинником успішного лікування ІАІ є хірургічний контроль джерела інфекції. Невдала хірургічна тактика пов’язана із підвищенням смертності більше ніж неадекватна емпірична антибіотикотерапія. [8,9.]. Однак сучасні хірургічні настанови розглядають хірургічний контроль інфекції, як мультидисциплінарну проблему, вирішення яке неможливе без антимікробної терапії. [10]. Отже вибір емпіричної антимікробної терапії лишається необхідним але складним завданням в умовах сучасного рівня резистентності.
Всесвітньої спілки невідкладної хірургії (WSES) рекомендує використовувати антимікробні схеми, які мають активність проти типових грамнегативних Enterobacteriaceae, грампозитивних коків та облігатних анаеробів, що є причиною ІАІ. Під це визначення підходить дуже багато антибіотиків та схем антимікробної терапії.
Не рекомендовано застосування схем на основі аміноглікозидів рутинно для емпіричної терапії (клас 1-B). Можливе використання цих препаратів для лікування новонароджених пацієнтів і для лікування ІАІ через резистентність грамнегативних мікроорганізмів у всіх пацієнтів, якщо інші препарати не підходять.
Не рекомендовано використання ампіцилін-сульбактаму рутинно для емпіричної терапії (клас 2-B) та амоксициліну з клавулановою кислотою для емпіричної терапії (клас 2-B).
Рекомендовано застосування піперацилін-тазобактаму для емпіричної терапії дорослих і дітей (клас 1-A), але зарезервуйте цей препарат переважно для пацієнтів із вищим ризиком через його антимікробну дію з ширшим спектром (клас 2-C).
Не рекомендовано використання цефазолін плюс метронідазол рутинно для емпіричної терапії (клас 2-C). Розглянути використання цефуроксиму плюс метронідазол як варіант емпіричної терапії дорослих і дітей із меншим ризиком (2-B клас). Можливе застосування цефотаксиму або цефтриаксону плюс метронідазол для емпіричної терапії дорослих і дітей із меншим ризиком (1-А клас). Можливе використання цефтазидиму та метронідазолу як варіант емпіричної терапії дорослих і дітей (клас 2-A), але зарезервуйте цю схему переважно для пацієнтів із вищим ризиком через його антимікробну дію з ширшим спектром дії (клас 2-C).
Використовуйте цефепім плюс метронідазол для емпіричної терапії дорослих і дітей (клас 1-A), але зарезервуйте цю схему переважно для пацієнтів із вищим ризиком через його антимікробну дію з ширшим спектром дії (клас 2-C). Можливе використання цефтолозан-тазобактаму та метронідазолу як варіант емпіричної терапії дорослих (клас 2-A), але зарезервуйте цю схему насамперед для пацієнтів із вищим ризиком, у яких є серйозна підозра або доведена інфекція резистентними штамами Pseudomonas aeruginosa, для яких інші агенти не підходять (клас 2-C).
Можливе використання цефтазидиму-авібактаму та метронідазолу як варіант емпіричної терапії дорослих (клас 2-A), але зарезервуйте цю схему в першу чергу для пацієнтів із вищим ризиком, у яких є серйозна підозра або доведена інфекція Klebsiella pneumoniae, що продукує карбапенемазу (KPC). Enterobacteriaceae, для яких інші засоби не підходять (клас 2-C).
Можливе викоритання ертапенему для емпіричної терапії дорослих і дітей із меншим ризиком (1-А клас). Використовуйте дорипенем для емпіричної терапії дорослих (клас 1-A), але зарезервуйте цей препарат переважно для пацієнтів із вищим ризиком через його антимікробну дію з ширшим спектром (клас 2-C). Не використовуйте дорипенем для емпіричної терапії дітей, якщо немає інших варіантів (клас 1-C). Використовуйте іміпенем-циластатин або меропенем для емпіричної терапії дорослих і дітей (клас 1-A), але зарезервуйте ці препарати переважно для пацієнтів із вищим ризиком через їх антимікробну дію з ширшим спектром дії (клас 2-C).
Можливе застосування азтреонам плюс метронідазол плюс ванкоміцин як варіант для емпіричної терапії дорослих і дітей (клас 2-B), для пацієнтів із підвищеним ризиком, хто має серйозну алергію на β-лактами.
Тайгециклін не рекомендовано для емпіричної терапії.
Використовуйте метронідазол як бажаний антианаеробний засіб у комбінованих схемах емпіричної терапії у дорослих і дітей (клас 1-B).
Можливе використання ампіциліну для емпіричної або патоген-спрямованої терапії чутливих штамів ентерококів у дорослих і дітей із підвищеним ризиком (2-B клас). Можливе використання ванкоміцину для емпіричної або патоген-спрямованої терапії чутливих до ванкоміцину Enterococcus faecium або метицилінрезистентних Staphylococcus aureus (MRSA) у дорослих і дітей із підвищеним ризиком (2-B клас). Включіть ванкоміцин у схему на основі азтреонаму для охоплення грампозитивних організмів (клас 2-B). Використання лінезоліду або даптоміцину для емпіричної або патоген спрямованої терапії інфекцій, спричинених резистентними до ванкоміцину Enterococcus spp. (VRE) і як альтернатива ванкоміцину при інфекціях, викликаних MRSA, у дорослих і дітей (клас 2-B).
Для пацієнтів високого ризику робоча група WSES пропонує, щоб пацієнти з вищим ризиком із ускладненої-IAI, особливо з сепсисом або септичним шоком, отримували емпіричну антимікробну терапію ширшого спектру, щоб мінімізувати ризик неадекватної початкової терапії. Агенти, які були включені до цієї категорії, це піперацилін-тазобактам, карбапенеми широкого спектру дії, іміпенем-циластатин, меропенем і дорипенем, а також цефепім плюс метронідазол. Застосування цефтазидиму та метронідазолу є варіантом, хоча це менш підтверджено сучасними даними. Подібним чином можна розглянути застосування азтреонаму плюс метронідазол плюс ванкоміцин, особливо для пацієнтів з тяжкими алергічними реакціями на β-лактами.
Хоча існують переконливі докази того, що антиентерококова терапія не потрібна пацієнтам із низьким ризиком із ускладненою IAI, менш ясно, чи це стосується пацієнтів із ускладненою-IAI із вищим ризиком. Частота виявлення ізолятів Enterococcus spp. здається, збільшується у пацієнтів із вищим ризиком порівняно з пацієнтами з нижчим ризиком. Виділення Enterococcus spp. також було пов’язано з гіршими клінічними наслідками, включаючи смерть, у деяких дослідженнях пацієнтів із вищим ризиком ускладненої IAI. Таким чином, робоча група прийшла до висновку, що існує доцільність надання емпіричного антиентерококкового покриття тяжкохворим пацієнтам із IAI. [11]
Обговорення та висновки
Автори розуміють, що не можна переносити данні закордонних досліджень на Україну, але то єдина відносно достовірна інформація з якою ми можемо працювати. Також при аналізі або імплементації закордонних рекомендацій треба пам’ятати про обмеження цих досліджень (професійна упередженість, неоднорідність даних в різних дослідницьких центрах, різний економічний стан держав, тощо, ці обмеження зазвичай вказані у результатах досліджень) та реалії наших можливостей (дефіцит середнього медичного персоналу, обмеженість фінансування, неналежна співпраця із мікробіологічними лабораторіями тощо).
Звичайно емпіричне призначення антимікробних препаратів має ґрунтуватись на місцевій епідеміології, важкості стану пацієнта та відповідати завданням клініки. Також треба враховувати такі фактори ризику, що інфекція може бути викликана мультирезистентною флорою. Фактори ризику цього:
- попереднє застосування антибіотиків (≤3 місяців);
- попередня госпіталізація (≤6 місяців);
- поточна госпіталізація більше 48 годин;
Але зважаючи на коштовність та складність вивчення мікробних пейзажів у наших закладах охорони здоров’я загалом, та ВАІТ особливо, довгий час неконтрольованого застосування «ексклюзивних» схем антибіотикотерапії наша емпірична антибіотикотерапія сама емпірична.
Цефалоспорини третьої генерації не рекомендовані до лікування хворих групи високого ризику з ускладненою ІАІ навіть, якщо такі хворі не потребують лікування у ВАІТ. 3 2018 року Європейський центр контролю за хворобами при вивченні резистентності не враховує цефтріаксон. В Україні наказом МОЗ №1513 від 23.08.23 цефтріаксон та левофлоксацин віднесені до групи резерву і не можуть бути призначені без узгодження із клінічним фармацевтом.
Але ще лишаються доступними цефотаксим, цефтазидим, цефоперазон та цефоперазон/сульбактам, мабуть їх емпіричне призначення має бути виключене для важких пацієнтів з ІАІ, а для пацієнтів середньої важкості обґрунтованим. Можливе призначення комбінації цефепім 1 – 2г. кожні 12 годин плюс метронідазол 0,5г. кожні 6 годин, пацієнтам без септичного шоку. Треба пам’ятати про відсутність антиентерококкової активності в такій комбінації. Також призначення цефалоспоринів III та IV генерації веде до селекції штамів, що продукують β-лактамази розширеного спектру проти яких частково зберігає активність піперацилін/тазобактам, а надійну активність мають лише карбапенеми. Що і призводить до їх підвищеного використання і провокує вже розвиток карбапенем-резистентності.
Таким чином, пусковим гачком резистентності грамнегативної флори є надмірне і необгрунтоване використання цефалоспоринів III та IV генерації. Оскільки плазміди з генами бета-лактамаз розширеного спектру часто містять і гени, що кодують механізми резистентності до фторхінолонів, то використання фторхінолонів теж сприяє поширенню резистентності як до них самих так і до цефалоспоринів III та IV генерації.
Подальше вивчення питання емпіричного антиентерококового покритя у хворих з ускладненою ІАІ, автори зазначають доцільність такого захисту лише для пацієнтів з високим ризиком або пацієнтів ВАІТ. [4]. Пам’ятаючи про повідомлення групи “AbSeS” про високу резистентність E. faecium до ампіцилін/сульбактаму більше 70%, для протиентерококкового захисту логічно призначати ванкоміцин 15мг/кг кожні 8 годин важким пацієнтам, що лікуються у ВАІТ. Хоча скоріше за все в Україні немає такої високої резистентності до ампіциліну, як у країнах Східної та Південно-Східної Європи, але це лише припущення.
Хоча звісно інтраабдомінальні інфекції є полі мікробними із переважанням Гр- флори, важливим є той факт, що при пошкодженні цілісності травної трубки вони частіше змішані аеробно-анаеробні, і тому анатианаеробна активність препаратів (або комбінації) є обов’язковою для пацієнтів цієї категорії.
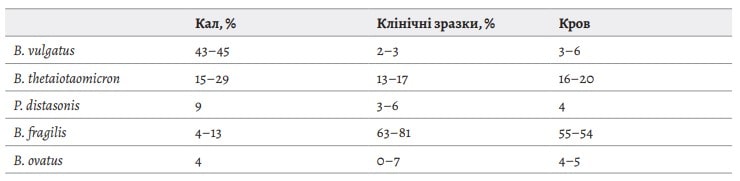
Серед анаеробів найбільш патогенними та домінуючими є група Bacteroides spp. Частота виявлення групи Bacteroides spp. та їх видовий склад в клінічних зразках від оперованих пацієнтів суттєво відрізняються від частоти виявлення у зразках калу див таб 1. [15] , що і свідчить про їх неоднакову патогенність та етіологічну роль в полімікробних асоціатах в першу чергу при перитонітах та інтраабдомінальних абсцесах внаслідок порушення цілісності травної трубки.
Таблиця 1. Частота виявлення різних видів Bacteroides spp. та споріднених з ними у зразках калу; зразках отриманих при хірургічних втручаннях і в крові.
Щільність маси мікроорганізмів та їх видовий склад в залежності від відділу кишечника давно і добре досліджено. Якщо розглядати травний тракт від шлунку до прямої кишки то загалом, чим дистальніше, тим більше кількість як загальна мікробної маси в 1 см3 кишкового вмісту так і кількість анаеробів і їх різноманіття. [14]. Мікробіом шлунково-кишкового тракту, певні види якої і є основними збудниками ІАІ, в тонкому кишечнику виразно відрізняється від мікробіому товстого кишечника, особливо це стосується анаеробів. Группа Bacteroides spp. Міститься переважно в товстому кишечнику зустрічається невелика кількість в тонкому. [14. 15]
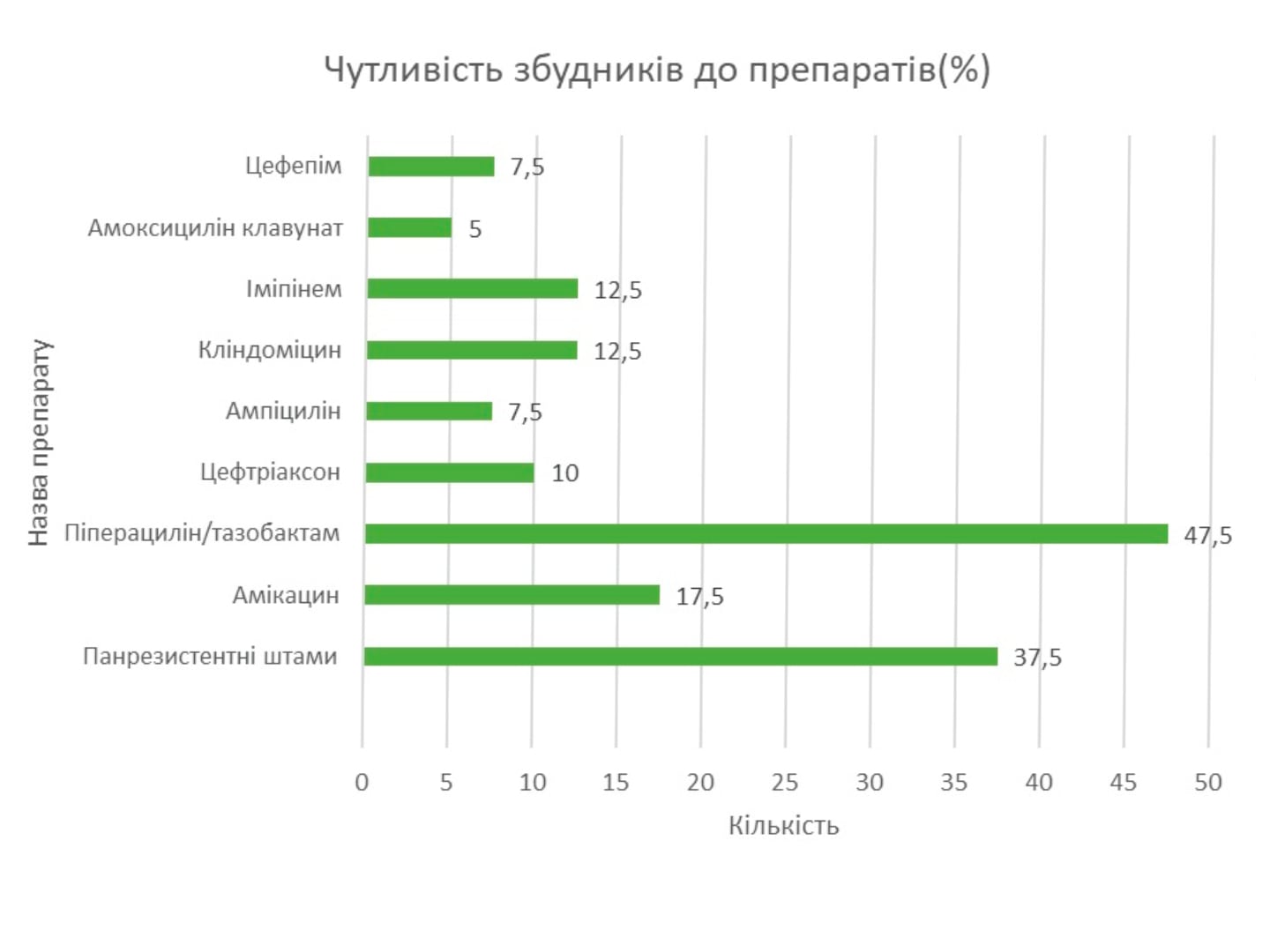
Чутливість бактероїдів у порівнянні з іншими препаратами з антианаеробною активністю [16].
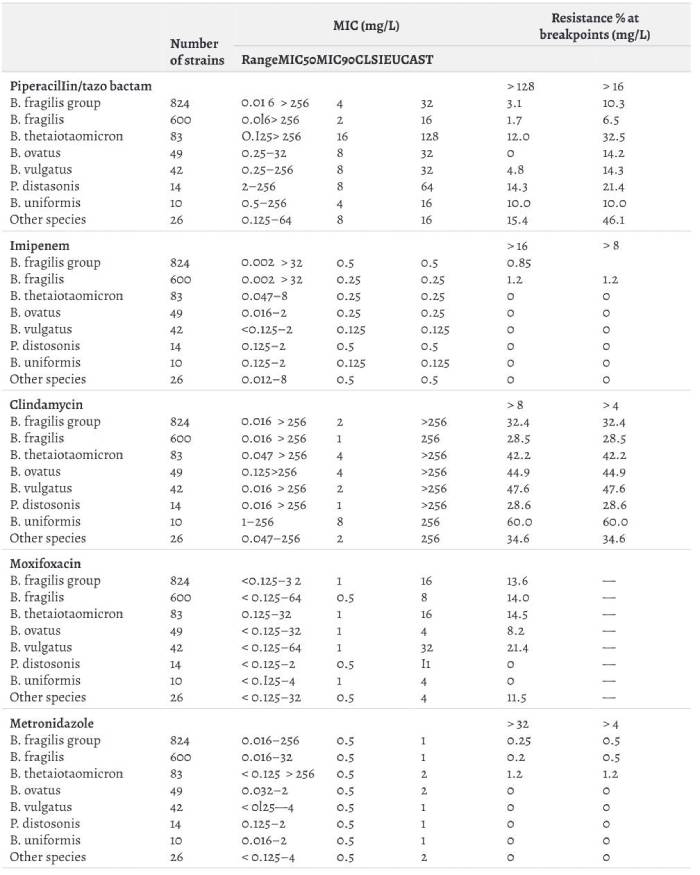
Зважаючи на широкий спектр дії, клінічно значиму анатианаеробну активність, низьку токсичність антиентерококову, антисиньогнійну активність, активність проти частини ентеробактерій що продукують бета-лактамази розширеного спектру вище сказане доцільно розглянути піперацилін/тазобактам в якості препарату першої лінії емпіричної терапії для пацієнтів із групи середнього ризику і значної частини пацієнтів з групи високого ризику, з ускладненою ІАІ, без септичного шоку. Кращих результатів у важких пацієнтів стабільних можна очікувати у випадках коли пацієнт високого ризику має IAI внаслідок перфорації якогось відділу тонкого кишківнику або при перфорації товстої кишки – тривалість перитоніту до 12 годин.
Піперацилін/тазобактам (PTZ), доступний в Україні під назвою Рефекс®. Його застосовують по 4,5 г кожні 6 – 8 годин шляхом як короткої 0,5 – 1 години, так і подовженої 3 – 4 години інфузії, а також шляхом постійної інфузії – перша 2,25 – 4,5 гр доза вводится болюсно або інфузія 15 хв і одразу підключається постійна інфузія 4,5 гр на 6 – 8 годин (13,5-18 г. доба) в США доступна форма випуску PTZ (36г./4.5г.) флакон: 40.5г. [17]. Пролонговані режими дозування а ще краще постійна інфузія дозволяє швидко і на потрібний час (не менше 50% часу між дозами) створити концентрацію PTZ 16 мкг/мл а інколи й вище, у більшості пацієнтів у плазмі, перитонеальній рідині та очеревині.
Створення таких стабільних концентрацій забезпечує не тільки перевищення мінімальної інгібуючої концентрації для всіх чутливих мікроорганізмів, а також дозволяє досягти ефекту проти частини ізолятів, які згідно критеріїв EUCAST v. 13.1 від 29 червня 2023 року відносяться до резистентних [12]. В той же час постійні інфузії дозволяють утримувати постійні концентрації піперациліну 22 – 35 мкг/мл [17]. Збільшення проценту часу між інфузіями, протягом якого концентрація утримується не нижче МІК а тим більше постійне утримання концентрації вище МІК, важливо для важких пацієнтів, це підвищує ефективність.
Треба зауважити, що для звичайних коротких інтермітуючих інфузій 4,5 гр кожні 8 годин Rationale Document від EUCAST v. 1.0 2010 рік декларують 50% часу мід дозами вірогідність утримання концентрацій вище 4 мкг/м – 99%, вірогідність утримання вище 8 мкг/мл в крові – 80% і лише 13% вірогідність утримання концентрації 16 мкг/мл. Це більш консервативна оцінка фармакокінетичних параметрів, і тому краще притримуватись її, ніж точки зору авторів із дослідження [12].
Перевагами PTZ є активність проти P. аeruginosa, деяких ентерококів, антианаеробна активність та відсутність застосування в Україні (не дивлячись на рекомендації по застосування піперацилін/тазобактаму для стартової емпіричної терапії в багатьох західних настановах в нашій державі він почав активно застосовуватись лише кілька років тому). Треба зазначити, що ентерококи нечутливі до ампіциліну будуть не чутливі і до PTZ, тому для повного антиентерококкового покритя у пацієнтів групи високого ризику доцільно додати ванкоміцин. При застосуванні PTZ необхідно ретельно моніторити стан коагуляції, та функцію нирок пацієнта.
Для певних категорій пацієнтів з IAI базою для стартової емпіричної терапії повинні бути карбапенеми з антиентерококовими препаратами. Це наступні категорії:
- пацієнти із інтраабдомінальною інфекцією та септичним шоком чи гемодинамічно нестабільні;
- пацієнти із важким каловим перитонітом;
- пацієнти у важкому стані, у яких джерелом інтраабдомінальної інфекції є перфорація будь якого відділу товстої кишки і з моменту перфорації пройшло більше 12 годин;
- пацієнти з будь яким станом важкості та рівнем перфорації, про яких є відомості що в них в останні 90 днів була грамнегативна інфекція чи колонізація викликана резистентними до цефалоспоринів 3 покоління та піперацилін/тазобактаму грамнегативними збудниками;
- пацієнти у важкому стані які за останні 90 днів мали госпіталізацію до ЗОЗ де високий рівень грамнегативних збудників резистентних до цефалоспоринів 3 покоління та піперацилін/тазобактаму але чутливих до карбапенемів (що відповідно вимагає створення не тільки національної системи моніторингу, а й регулярної публікації цих даних на виділеному для цього он-лайн ресурсі);
- пацієнти з інфікованим панкреонекрозом.
Антиентерокововим препаратом для цієї категорії пацієнтів в нашій ситуації переважно буде ванкоміцин. Додання чи не додання антиентерококових препаратів залежить від обраного карбапенему, важкості стану пацієнта та наявності епідеміологічної інформації про попередню колонізацію чи інфікування пацієнта ентерококами та профіль фенотип їх чутливості.
Коли непотрібно додавати ванкоміцин:
- проводиться моніторинг колонізації пацієнта і за останні 7 днів не виявлялось ентерококів;
- пацієнту в якості базового карбапенему обрано іміпенем, а по даним моніторингу колонізуючої флори виділявся ентерококк чутливий до іміпенему;
- проводиться моніторинг колонізації пацієнта і за останні 7 днів виявлялись ентерококи, але чутливі до ампіциліну та з позитивним тестом на синергію з гентаміцином можемо обрати ампіцилін + гентаміцин [25]. ( для нормальної функції нирок ампіцилін 1 грам кожні 4 години+гентаміцин 1 мк/кг кожні 8 годин. Після отримання результатів мікробіологічного дослідження якщо ентерококи не виявлені ампіцилін з гентаміцином слід відмінити);
- пацієнт в неважкому стані і карбапенеми будуть призначатись через відомості, що в них в останні 90 днів була грамнегативна інфекція чи колонізація викликана резистентними до цефалоспоринів 3 покоління та піперацилін/тазобактаму грамнегативними збудниками. Але, по даним цих же мікробіологічних досліджень ентерококів не виявляли;
- проводиться моніторинг колонізації пацієнта і за останні 7 днів виявлялись ентерококи, але резистентні до ванкоміцину Опцією можна обрати призначається лінезолід по 600 мг кожні 12 годин або даптоміцин 8 мг/кг/добу [19,25]. Після отримання результатів мікробіологічного дослідження, якщо ванкоміцин-резистентні ентерококи, чи інші грампозитивні збудники що потребують призначення лінезоліду, не виявлені то лінезолід або даптоміцин можна відмінити).
На жаль, резистентність досягла такого рівня, що для певних категорій пацієнтів з IAI базою для стартової емпіричної терапії повинні бути препарати з активністю проти карбапенем-резистентних ентеробактерій з доданням антиентерококових та антианаеробних препаратів. Це наступні категорії пацієнтів
- пацієнти із інтраабдомінальною інфекцією у важкому стані, які за останні 90 днів мали госпіталізацію до ЗОЗ де високий рівень ентеробактерій резистентних до карбапенемів;
- пацієнти з будь яким станом важкості та рівнем перфорації, про яких є відомості що в них в останні 90 днів була грамнегативна інфекція чи колонізація викликана резистентними карбапенемів ентеробактеріями.
Вибір для антимікробної терапії таких пацієнтів є одночасно і проблемою і досить простим. Проблемою є через високу резистентність, і немає 100% ефективних препаратів чи комбінацій, а простим, тому що вибір препаратів надзвичайно обмежений. (Нижче йде мова про препарати доступні в Україні). Відповідно, з наведеного випливає, що для частини пацієнтів вже просто немає ефективних антимікробних препаратів.
З препаратів та комбінацій, які можна рекомендувати для емпіричної терапії карбапенем-резистентних ентеробактерій [18-24], в Україні є лише цефтазидим/авібактам, можливість одночасного призначення цефтазидим/авібактаму з азтреонамом, та можливо використання поліміксину В, колістину чи парентерального фосфоміцину у високих дозах, можливо в комбінаціях з вищеназваними препаратами. Призначення системних поліміксинів та парентерального фосфоміцину як препаратів останнього резерву повинно здійснюватись після затвердження клінічним фармакологом ЗОЗ, або консиліумом із залученням завідувача відділенням. Тому зараз зупинимось на призначенні цефтазидим/авібактаму з/без азтреонаму.
Хоча данні по чутливості карбапенем-резистентних ентеробактерій до цефтазидим/авібактаму в Україні системно не аналізувалися, згідно особистого досвіду авторів та комунікації з лабораторіями великих клінік, в деяких клініках чутливість карбапенем-резистентних ентеробактерій до цефтазидим/авібактаму менше 50%. Механізми цієї резистентності в Україні досліджені на жаль погано. Але виходячи із світових даних можна припустити що переважно це поєднання продукції тих бета-лактамаз які авібактам блокує (бета-лактамази широкого спектру, AmpC-бета-лактамази, КРС, ОХА-48 карбапенемази) з металобеталактамазами, які авібактам не блокує.
Можливим рішенням в цій ситуації може бути комбінація цефтазидим/авібактаму з азтреонамом [18-24]. Хоча, азтреонам гідролізується бета-лактамазами широкого спектру, AmpC-бета-лактамазами, КРС, ОХА-48 карбапенемазами він мало піддається гідролізу металобеталактазами. Тому комбінація цефтазидим/авібактам+азтреонам в багатьох випадках є ефективною проти ізолятів ентеробактерій, що резистентні до цефтазидим/авібактаму [18-24]. Хоча, якщо до описаних механізмів резистентності додаються ще й порушення проникності мікробної стінки чи ефлюкс антибіотиків то ефективність її проти карбапенем-резистентних ентеробактерій може знижуватись або бути відсутньою.
Відносно частини карбапенем-резистентних P.aeruginosa цефтазидим/авібактам теж має активність. На жаль відносно карбапенем-резистентних A.baumanii цефтазидим/авібактам не має суттєвої активності.[22, 23, 24]
Антиентерокововим препаратом для цієї категорії пацієнтів в нашій ситуації буде ванкоміцин. (також див. частину де описано вибір антиентерококового препарату на додаток до карбапенемів).
Також потрібно враховувати, що ані цефтазидим/авібактам ані комбінація цефтазидим/авібактам+азтреонам не має суттєвої активності проти анаеробів. Тому при їх призначенні при ІАІ потрібно додавати метронідазол.
Таким чином, емпірична терапія що впливає на карбапенем-резистентні ентеробактерії для пацієнтів з нормальною функцією нирок буди виглядати так цефтазидим-авібактам 2,5 грами інфузія 2 години кожні 8 годин+метронідазол 500 мг інфузія 30 хв кожні 6 годин (якщо очікується що карбапенем-резистентні ентеробактерії чутливі до цефтазидим/авібактаму) або цефтазидим-авібактам 2,5 грами інфузія 2 години кожні 8 годин+азтреонам 2 грами інфузія 2 години кожні 8 годин+ метронідазол 500 мг інфузія 30 хв кожні 6 годин. Логічно, до отримання інформації щодо збудника та механізмів резистентності, призначати цефтазидим/авібактам з азтреонамом, а не в монотерапії.
Цефтазидим/авібактам і азтреонам також можна вводити подовженими чи постійними інфузіями, показання до цього має визначати клінічний фармаколог чи інший спеціаліст з антимікробної терапії.
Щодо безпеки включення ванкоміцину в основні схеми емпіричної антибіотикотерапії важких ІАІ було виконано мультіцентрове дослідження де порівнювали пиптаз + ванко проти цефепім + ванко та меропенем +ванко. Результат, комбінація пиптаз + ванко частіше викликає гостре пошкодження нирок ніж цефепім + ванко та меропенем +ванко, але відсутня різниця у виживаності та смертності у всіх групах дослідження.[26].
Також вкрай важлива така проста річ, як дотримання протоколу антибіотикотерапії для виживання пацієнта, при чому багато залежить від людського фактору, одним із факторів ризику недотримання протоколу був вік анестезіологів більше 36 років. [27]. (Автори розуміють спірність цього твердження і не підтримують його, але він опублікований).
Зважаючи на сказане здається логічним початковою емпіричною антибіотикотерапією середніх та важких ІАІ без септичного шоку, та попередніх даних про наявність мультирезистентної флори вважати схеми на основі піперацилін/тазобактаму. А власне вирішення проблеми лікування важких інтраабдомінальних інфекцій та абдомінального сепсису залежить від якості мультидисциплінарного подходу: хірургічна служба, служба анестезіології та інтенсивної терапії, відділу інфекційного контролю, лабораторної діагностики та мікробіологічної діагностики особливо. Емпірична антибіотикотерапія повинна перейти в терапію на основі визначення мікроорганізмів, механізмів їх резистентності та чутливості так швидко, як це можливо.
Автори:
- Доморацький О.Е. (Кафедра анестезіології та інтенсивної терапії НУОЗ імені П.Л. Шупика, ПП «Клініка МЕДІКОМ»)
- Ярошук Д.В. (Кафедра хірургії стоматологічного факультету НМУ імені О.О. Богомольця)
- Гладкіх В.Ю. (КНП «Вінницький регіональний клінічний лікувально-діагностичний центр серцево-судинної патології»)
- Михайленко Д.Є. (ПП «Клініка МЕДІКОМ»)
- Павленко О.І. (КНП «Київська міська клінічна лікарня швидкої медичної допомоги»)
Література:
- «Prevalence and Outcomes of Infection Among Patients in Intensive Care Units in 2017» Jean-Louis Vincent, MD, PhD, Yasser Sakr, MD, PhD, Mervyn Singer, MB, BS, Ignacio Martin-Loeches, MD, Flavia R. Machado, MD, PhD, John C. Marshall, MD, Simon Finfer, MB, BS, Paolo Pelosi, MD, Luca Brazzi, MD, PhD, Dita Aditianingsih, MD, PhD, Jean-François Timsit, MD, PhD Bin Du, MD, Xavier Wittebole, MD, Jan Máca, MD, Santhana Kannan, MD, Luis A. Gorordo-Delsol, MD, Jan J. De Waele, MD, Yatin Mehta, MD, Marc J. M. Bonten, MD, Ashish K. Khanna, MD, Marin Kollef, MD, Mariesa Human, RN, and Derek C. Angus, MD, for the EPIC III Investigators//JAMA. 2020 Apr 21; 323(15): 1478–1487.doi: 10.1001/jama.2020.2717
- «Infections of respiratory or abdominal origin in ICU patients: what are the differences?» Volakli E, Spies C, Michalopoulos A, Groeneveld AB, Sakr Y, Vincent JL.// Crit Care. 2010;14:R32. doi: 10.1186/cc8909.
- «Prevalence, predictors, and consequences of inappropriate empiric antimicrobial therapy for complicated urinary tract and intra-abdominal infections in Winnipeg hospitals» Christiaan H Righolt, Philippe Lagace-Wiens, Salaheddin M Mahmud //Diagn Microbiol Infect Dis. 2020 Jan;96(1):114891.doi: 10.1016/j.diagmicrobio.2019.114891.
- «Systematic review and meta-analysis of the efficacy of appropriate empiric anti-enterococcal therapy for intra-abdominal infection.» Zhang J, Yu W-Q, Chen W, Wei T, Wang C-W, Zhang J-Y, et al.//Surg Infect (Larchmt). 2021;22:131–43.
- «Antimicrobial Lessons From a Large Observational Cohort on Intra-abdominal Infections in Intensive Care Units.» Vogelaers, D., Blot, S., Van den Berge, A., Montravers, P., Francois, G., Labeau, S., Lipman, J. (2021).// Drugs, 81(9), 1065–1078. doi:10.1007/s40265-021-01534-
- «Epidemiology of intra-abdominal infection and sepsis in critically ill patients: “AbSeS”, a multinational observational cohort study and ESICM Trials Group Project» Stijn Blot, Massimo Antonelli, Kostoula Arvaniti, Koen Blot, Ben Creagh-Brown, Dylan de Lange, Jan De Waele, Mieke Deschepper, Yalim Dikmen, George Dimopoulos, Christian Eckmann, Guy Francois, Massimo Girardis, Despoina Koulenti, Sonia Labeau, Jeffrey Lipman, Fernando Lipovestky, Emilio Maseda, Philippe Montravers, Adam Mikstacki, José-Artur Paiva, Cecilia Pereyra, Jordi Rello, Jean-Francois Timsit, Dirk Vogelaers, and the Abdominal Sepsis Study (AbSeS) group on behalf of the Trials Group of the European Society of Intensive Care Medicine // Intensive Care Med. 2019; 45(12): 1703–1717.
- European Centre for Disease Prevention and Control. Surveillance atlas of infectious diseases. atlas.ecdc.europa.eu/public/index.aspx. Accessed 1 Oct 2020.
- «Prevalence, underlying causes, and preventability of Sepsis-Associated Mortality in US Acute Care Hospitals.» Rhee C, Jones TM, Hamad Y, Pande A, Varon J, O’Brien C, Anderson DJ, Warren DK, Dantes RB, Epstein L, Klompas M, Centers for Disease Control and Prevention (CDC) Prevention Epicenters Program.// JAMA Netw Open. 2019;2(2):e187571
- «Association between time to source control in Sepsis and 90-day mortality.» Reitz KM, Kennedy J, Li SR, Handzel R, Tonetti DA, Neal MD, Zuckerbraun BS, Hall DE, Sperry JL, Angus DC, Tzeng E, Seymour CW.// JAMA Surg. 2022;13:e222761
- «Source control in emergency general surgery: WSES, GAIS, SIS-E, SIS-A guidelines» Federico Coccolini,corresponding, Massimo Sartelli, Robert Sawyer, Kemal Rasa, Bruno Viaggi, Fikri Abu-Zidan, Kjetil Soreide, Timothy Hardcastle, Deepak Gupta, Cino Bendinelli, Marco Ceresoli, Vishal G. Shelat, Richard ten Broek, Gian Luca Baiocchi, Ernest E. Moore Ibrahima Sall, Mauro Podda, Luigi Bonavina, Igor A. Kryvoruchko, Philip Stahel, Kenji Inaba, Philippe Montravers, Boris Sakakushev, Gabriele Sganga, Paolo Ballestracci, Manu L. N. G. Malbrain, Jean-Louis Vincent, Manos Pikoulis, Solomon Gurmu Beka, Krstina Doklestic, Massimo Chiarugi, Marco Falcone, Elena Bignami, Viktor Reva, Zaza Demetrashvili, Salomone Di Saverio, Matti Tolonen, Pradeep Navsaria, Miklosh Bala, Zsolt Balogh, Andrey Litvin, Andreas Hecker, Imtiaz Wani, Andreas Fette, Belinda De Simone, Rao Ivatury, Edoardo Picetti, Vladimir Khokha, Edward Tan, Chad Ball, Carlo Tascini, Yunfeng Cui, Raul Coimbra, Michael Kelly, Costanza Martino, Vanni Agnoletti, Marja A. Boermeester, Nicola De’Angelis, Mircea Chirica, Walt L. Biffl, Luca Ansaloni, Yoram Kluger, Fausto Catena, and Andrew W. Kirkpatrick// World J Emerg Surg. 2023; doi: 10.1186/s13017-023-00509-4
- «The Surgical Infection Society Revised Guidelines on the Management of Intra-Abdominal Infection» John E. Mazuski, Jeffrey M. Tessier, Addison K. May, Robert G. Sawyer, Evan P. Nadler, Matthew R. Rosengart, Phillip K. Chang, Patrick J. O’Neill, Kevin P. Mollen, Jared M. Huston, Jose J. DiazJr, and Jose M. Prince // Surgical InfectionsVol. 18, No. 1 doi.org/10.1089/sur.2016.261
- «Pharmacokinetics of piperacillin-tazobactam in plasma, peritoneal fluid and peritoneum of surgery patients, and dosing considerations based on site-specific pharmacodynamic target attainment» Naoki Murao, Hiroki Ohge, Kazuro Ikawa, Yusuke Watadani, Shinnosuke Uegami, Norifumi Shigemoto, Norimitsu Shimada, Raita Yano, Toshiki Kajihara, Kenichiro Uemura , Yoshiaki Murakami, Norifumi Morikawa, Taijiro Sueda// Int J Antimicrob Agents . 2017 Sep;50(3):393-398. doi: 10.1016/j.ijantimicag.
- «Vancomycin with concomitant piperacillin/tazobactam vs. cefepime or meropenem associated acute kidney injury in the critically ill: A multicenter propensity score-matched study» Mitchell S Buckley, Ivan A Komerdelj, Paul A D’Alessio, Pooja Rangan, Sumit K Agarwal, Nicole C Tinta, Brandon K Martinez, Delia S Ziadat, Melanie J Yerondopoulos, Emir Kobic, Sandra L Kane-Gill // J Crit Care. 2022 Feb;67:134-140. doi: 10.1016/j.jcrc.2021.10.018.
- «Clinical Microbiology And Infectious Diseases: An Illustrated Colour Text» by W. John Spicer / Edition 2 p.22
- «Molecular Medical Microbiology.» Chapter 51 Bacteroides p.918 by Sheila Patrick DOI: dx.doi.org/10.1016/B978-0-12-397169-2.00051-2
- «Antimicrobial susceptibility of Bacteroides fragilis group isolates in Europe: 20 years of experience» Nagy, E. Urbán, Carl Erik Nord on behalf of the ESCMID Study Group on Antimicrobial Resistance in Anaerobic Bact //Clinical Microbiology and Infection, 2011 March,Volume 17 Number 3, p. 371 – 379
- «Population pharmacokinetics and pharmacodynamics of piperacillin/tazobactam in patients with complicated intra-abdominal infection.» Li C, Kuti JL, Nightingale CH, Mansfield DL, Dana A, Nicolau DP.//J Antimicrob Chemother. 2005 Aug;56(2):388-95. doi: 10.1093/jac/dki243.
- «The “Old” and the “New” Antibiotics for MDR Gram-Negative Pathogens: For Whom, When, and How.» Karaiskos I, Lagou S, Pontikis K, Rapti V and Poulakou G (2019)//Front. Public Health 7:151. doi: 10.3389/fpubh.2019.00151
- «Antimicrobial resistance in ESKAPE pathogens.» De Oliveira DMP, Forde BM, Kidd TJ, Harris PNA, Schembri MA, Beatson SA, Paterson DL, Walker MJ. 2020 //Clin Microbiol Rev 33:e00181-19. org/10.1128/CMR.00181-19.
- «Treatment of infections caused by multidrug-resistant Gram-negative bacteria: report of the British Society for Antimicrobial Chemotherapy/Healthcare Infection Society Hawkey PM, Warren RE, Livermore DM, McNulty CAM, Enoch DA, Otter JA, Wilson APR. /British Infection Association Joint Working Party.// J Antimicrob Chemother. 2018 Mar 1;73(suppl_3):iii2-iii78. doi: 10.1093/jac/dky027. PMID: 29514274.
- « European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug-resistant Gram-negative bacilli (endorsed by European society of intensive care medicine)». Paul M, Carrara E, Retamar P, Tängdén T, Bitterman R, Bonomo RA, de Waele J, Daikos GL, Akova M, Harbarth S, Pulcini C, Garnacho-Montero J, Seme K, Tumbarello M, Lindemann PC, Gandra S, Yu Y, Bassetti M, Mouton JW, Tacconelli E, Rodríguez-Baño //Clin Microbiol Infect. 2022 Apr;28(4):521-547. doi: 10.1016/j.cmi.2021.11.025.
- «Guidance on the Treatment of Extended-Spectrum β-lactamase Producing Enterobacterales (ESBL-E), Carbapenem-Resistant Enterobacterales (CRE), and Pseudomonas aeruginosa with Difficult-to-Treat Resistance (DTR-P. aeruginosa).» Tamma PD, Aitken SL, Bonomo RA, Mathers AJ, van Duin D, Clancy CJ. Infectious Diseases Society of America 2022//Clin Infect Dis. 2022 Aug 25;75(2):187-212. doi: 10.1093/cid/ciac268.
- «Guidance on the Treatment of AmpC β-Lactamase-Producing Enterobacterales, Carbapenem-Resistant Acinetobacter baumannii, and Stenotrophomonas maltophilia Infections.» Tamma PD, Aitken SL, Bonomo RA, Mathers AJ, van Duin D, Clancy CJ. Infectious Diseases Society of America//Clin Infect Dis. 2022 Jul 6;74(12):2089-2114. doi: 10.1093/cid/ciab1013.
- «Current and future perspectives in the treatment of multidrug-resistant Gram-negative infections.» Bassetti M, Garau J.//J Antimicrob Chemother. 2021 Nov 22;76(Suppl 4):iv23-iv37. doi: 10.1093/jac/dkab352,
- «Enterococcal resistance–an overview.» Marothi YA, Agnihotri H, Dubey D.//Indian J Med Microbiol. 2005 Oct;23(4):214-9.
- «Vancomycin with concomitant piperacillin/tazobactam vs. cefepime or meropenem associated acute kidney injury in the critically ill: A multicenter propensity score-matched study» Mitchell S Buckley, Ivan A Komerdelj, Paul A D’Alessio, Pooja Rangan, Sumit K Agarwal, Nicole C Tinta, Brandon K Martinez, Delia S Ziadat, Melanie J Yerondopoulos , Emir Kobic, Sandra L Kane-Gill// J Crit Care. 2022 Feb;67:134-140. doi: 10.1016/j.jcrc.2021.10.018.
- «Compliance with an empirical antimicrobial protocol improves the outcome of complicated intra-abdominal infections: a prospective observational study»M. Guilbart, E. Zogheib, A. Ntouba, L. Rebibo, J. M. Régimbeau, Y. Mahjoub and H. Dupont// Br J Anaesth. 2016 Jul; 117(1): 66–72. doi: 10.1093/bja/aew117