Інтра-абдомінальна інфекція: перитоніт як абдомінальний сепсис. Принципи інтенсивної терапії
Резюме. Гострий розповсюджений перитоніт є одним з найтяжчих та найчастіших захворювань в абдомінальній хірургії. Летальність при цьому захворюванні не знижується менше 24–35 %, при розвитку септичного шоку складає 60–70 %, а в разі приєднання СПОН сягає 80–100 %.
Абдомінальний сепсис (АС) у даний час визначається як підвищення оцінки за шкалою SOFA на ≥ 2 бали через внутрішньочеревну інфекцію. Якщо пацієнту потрібне застосування вазопресорів для підтримання середнього артеріального тиску ≥ 65 мм рт. ст. (незважаючи на адекватне заповнення об’єму рідини) та рівень лактату у сироватці ≥ 2 ммоль/л, клінічна ситуація визначається як септичний шок.
Із способів ранньої діагностики абдомінального сепсису на сьогодні визнано моніторинг рівня прокальцитоніну та рівень С-реактивного білка, що вирішує питання верифікації бактерійної етіології сепсису, прогнозування його перебігу, тривалість проведення антибактеріальної терапії.
Мікробіологічна діагностика перитоніту як основної форми АС є обов’язковою.
Ефективне лікування ІАІ – раннє розпізнавання та усунення джерела, промивання черев-ної порожнини, виведення ексудату і міждисциплінарне лікування антибіотиками в умовах інтенсивної терапії.
Ключові слова: інтраабдомінальна інфекція, перитоніт, абдомінальний сепсис, антибіотики.
Стаття. Інтраабдомінальні інфекції (ІАІ) є поширеними невідкладними хірургічними станами, і вони є основною причиною нетравматичної смерті у відділеннях невідкладної хірургії в усьому світі [1]. Гострий розповсюджений перитоніт є одним з таких станів, найтяжчих та найчастіших захворювань в абдомінальній хірургії. Летальність при при цьому захворюванні не знижується нижче 24-35%, а при розвитку септичного шоку складає 60-70%, а у разі приєднання СПОН досягає 80-100% [2].
Основні причини гострого перитоніту (ГП) це гострі запальні процеси в органах черевної порожнини, малого тазу та позаочеревинного простору, перфорації порожнистих органів черевної порожнини, закриті та проникаючі ушкодження органів черевної порожнини та малого тазу та післяопераційні перитоніти.
Перитоніт є ускладненням ІАІ, його необхідно розглядати як абдомінальний сепсис, особливу форму відповіді очеревини на клінічно значущий ендо- чи екзогенний мікробний етіофактор. Перитоніт, незалежно від етіології, є явищем системним, а патофізіологічні механізми розвитку сепсису значною мірою є результатом відповіді вродженого імунітету пацієнта. Інфекції або хірургічні травми очеревини викликають імунну відповідь з початковим переважанням моноцитів, які продукують прозапальні цитокіни та інтерферон. Вивільняються протизапальні цитокіни, включаючи IL-4, IL-10, щоб контролювати рівень запалення та захищати господаря від загострення запальної реакції.
Основу патогенезу розповсюдженого перитоніту у стадії абдомінального сепсису становить порушення бар’єрної функції епітелію слизової тонкої кишки, прорив інфекційно-токсичних факторів у кровоносну систему з розвитком септичного шоку та мультиорганних дисфункцій. Головним джерелом ендотоксикозу є бактеріальна транслокація з кишечника в черевну порожнину та портальний кровотік. Масове надходження бактерій та їх токсинів по портальних судинах у печінку наводять до порушення бар’єрної функції печінки, пошкодження зірчастих ретикулоендотеліоцитів та формування макрофагальної печінкової недостатності.
Суттєвий вплив на перебіг та прогноз перитоніту має етіологія та походження флори – внутрішня чи позалікарняна. Позалікарняна флора має добре вивчений склад, поширеність, патогенний потенціал та спектр антибіотикочутливості. Нозокоміальна є непорівняно вірулентнішою, малопрогнозованою, слабоконтрольованою та менш чисельною [3].
Surviving Sepsis Campaign (Сепсис-3) [4] більше не фокусується на ознаках та симптомах запалення, що може відбивати реакцію на системну інфекцію. Натомість у Sepsis-3 наголошується, що при сепсисі реакція господаря не здорова, а порушена регуляція, що призводить до дисфункції органів достатнього ступеня тяжкості, щоб бути небезпечною для життя. Конкретний сепсис визначається як «загрозлива для життя органна дисфункція, спричинена порушенням регуляції реакції господаря на інфекцію». Дисфункція органів вимірюється за оцінкою послідовної органної недостатності (SOFA). Таким чином, «абдомінальний сепсис» в даний час визначається як підвищення оцінки за шкалою SOFA на ≥ 2 бали через внутрішньочеревну інфекцію.
Якщо пацієнту потрібне застосування вазопресорів для підтримання середнього артеріального тиску (САТ) ≥65 мм рт. ст. (незважаючи на адекватне заповнення об’єму рідини) та рівень лактату у сироватці ≥ 2 ммоль/л, клінічна ситуація визначається як септичний шок. Термін «важкий сепсис» був скасований і не повинен використовуватися [5]. На відміну від комплексної оцінки за шкалою SOFA, оцінка за шкалою qSOFA є повсякденним інструментом для клініцистів, що дозволяє швидко класифікувати пацієнта, наприклад, у відділенні невідкладної допомоги) [5].
Клінічний перебіг перитоніту має три стадії: 1)реактивна стадія (до 24 год з часу захворювання), 2)токсична стадія (від 24 до 72 год від початку захворювання), в)термінальна стадія (після 72 год після початку захворювання) [6]. Клінічний перебіг перитоніту характеризується порушенням стану серцево-судинної системи і мікроциркуляції, волемічного та гомеостатичного стану систем організму. Постійно зростає больовой синдром і інтоксикація за рахунок розвитку деструктивного запального або некротичного процесу в органах черевної порожнини та залучення до нього очеревини. Все це наводить до розвитоку ПОН [6].
Розповсюджений перитоніт, ураження більше п’яти анатомічних областей або два поверхи черевної порожнини, залишається одним із найбільш загрозливих ускладнень в невідкладній хірургії і за своєю важкістю займає провідне місце серед гострої хірургічної патології. Характер ексудату: серозний, фібринозний, гнійний, геморагічний (та їх поєднання).
Вторинний перитоніт (ВП) – найчастіша форма абдомінальної інфекції та основна причина абдомінального сепсису у хірургічних хворих. У 80% випадків причиною вторинного перитоніту є деструктивні ураження органів черевної порожнини, у 20% випадків післяопераційний перитоніт розвивається після різних втручань на органах черевної порожнини.У структурі перитонітів частка ВП досягає 90%, при чому післяопераційні складають близько 30% [7].
Перфорація тонкої або товстої кишки через 2 години призводить до інфікування черевної порожнини грамнегативними факультативними бактеріями та анаеробною облігатною мікрофлорою, грампозитивними коками та паличками [7]. При гострому холециститі, ускладненому перипузирним абсцесом і невідмежованим перитонітом, характер мікрофлори стає практично ідентичним мікробному пейзажу товстої кишки [7]. У пізні терміни, незалежно від рівня пошкодження шлунково-кишкового тракту, мікробний спектр черевної порожнини включатиме асоціації аеробної та анаеробної флори [7].
Третинний перитоніт (ТП), або перитоніт без джерела інфекції, становить особливу проблему для діагностики, хірургічного та антибактеріального лікування. Ця рецидивна та персистуюча форма перитоніту розвивається у хворих у критичних станах з пошкодженням механізмів протиінфекційного захисту. Клінічні прояви такого перитоніту стерті, характеризуються гіпердинамічними порушеннями кровообігу, помірною гіпертермією, поліорганною дисфункцією без чіткої місцевої симптоматики внутрішньочеревної інфекції.
Причиною цієї форми перитоніту є інфікування мультирезистентними штамами коагулазонегативних стафілококів, ентерококів, ентеробактерій, псевдомонад або грибами Candida spp., що характерно для нозокоміальної інфекції. Основними патогенами, пов’язаними з TP, є ентерококи (15-35%), коагулазо-позитивні стафілококи (5-30%), Candida spp (10-30%) і Escherichia coli (10-30%). тоді як поширеність Pseudomonas spp, Enterobacter spp, Bacteroides spp, Klebsiella spp і Staphylococcus aureus часто нижче 10% [8]. ТП зазвичай описують як персистуючий або рецидивуючий перитоніт, що виникає через 48 годин після адекватного хірургічного лікування джерела. Це еволюція ВП, і його не слід розглядати як окремі нозології.
За останні роки здійснено впровадження нових технологій, методик діагностики і лікування розповсюдженого перитоніту, вдосконалення техніки оперативних втручань, розширення можливостей медикаментозної терапії, розробка комплексних заходів періопераційного лікування цієї складної патології.
Із способів ранньої діагностики абдомінального сепсису поряд із традиційними загальноклінічними аналізами на сьогодні визнано прокальцитонін (ПКТ), який вирішує питання верифікації бактерійної етіології сепсису, прогнозування його перебігу, тривалість проведення антибактеріальної терапії (АБТ). Зниження ПКТ на 80% від вихідного значення або ПКТ у сироватці крові <0,5 мкг/дл були пороговими значеннями для припинення лікування антибіотиками. Післяопераційне зниження прокальцитоніну розцінюють, як ознаку вдалої елімінації септичного джерела в черевній порожнині [1, 7].
Моніторинг рівня С-реактивного білка (СРБ) та тріггер-рецептора TREM-1 дозволив на ранніх етапах діагностувати сепсис у хворих, зокрема встановити взаємопричинність фебрильної реакції та бактеріємії. СРБ є позитивним реактантом гострої фази запалення, досягає піку між 2-м і 3-м днями після операції (приблизно через 12-24 години після піку інтерлейкіну (ІЛ)-6) і знижується до вихідного рівня на 5-й день після операції. На інформаційність СРБ як маркера перебігу сепсису вказує його стрімке зростання при переході ВП у ТП. [1, 7].
Мікробіологічна діагностика перитоніту як основної форми АС є обов’язковою, її інформативність залежить від часу забору зразка гемокультури відносно початку АБТ, антисептичних впливів, кількісті ексудату з черевної порожнини. Культури крові мають бути зібрані до будь-якого антимікробного лікування. Від двох до трьох пар (аеробних та анаеробних) зразків гемокультури слід брати як з периферичної крові, так і з центральних венозних катетерів. Будь-яка антибіотикотерапія різко знижує виявленість методом посіву крові [5]. На відміну від посіву крові, методи на основі ПЛР дозволяють швидко ідентифікувати бактерії та пов’язану з ними резистентність до протимікробних препаратів [5].
Для швидкого огляду потенційних патологічних станів очеревини є ультразвук, якій допомагає діагностувати внутрішньочеревні абсцеси, гематоми та ін. Дозволяє проводити дренування підозрілих скупчень рідини під ультразвуковим контролем [5].
Використовуються математичні шкали (SOFA, MODS, SAPS, APACHE-2 та -3, МІП, POSSUM) для оцінки тяжкості стану хворого й прогнозування летального результату при вторинному перитоніті, але вони є непридатними для діагностики чи прогнозування третинного перитоніту.
Факторами, які довели високу прогностичну точність у визначенні ризику розвитку третинного перитоніту, виявились тривалість операції (>120 хв.), кількість перитонеального ексудату (>1000 мл), дифузність та невідмежованість перитоніту, кількість уражених анатомічних зон (>4), Мангеймський індекс перитоніту (ступінь тяжкості ІІІ), шкала APACHE-3 (≥100 балів), тривалість штучної вентиляції легень (>10 год), гемоглобін периферійної крові (<100 г/л), лімфоцити периферійної крові (<15 %), лейкоцитарний індекс інтоксикації (>7), фагоцитарний індекс (<95), кортизол сироватки крові (≤1500 нмоль/л), прокальцитонін сироватки крові (>12 нг/мл), загальний білок сироватки крові (<70 г/л), IgA (≤8 г/л), IgM (≤6 г/л), інтерлейкін-10 (≤17 пг/мл) та сечовина сироватки крові (>7,5 ммоль/л) [3].
Запорука ефективного лікування ІАІ є раннє розпізнавання, адекватний контроль джерела, відповідна антимікробна терапія та швидка фізіологічна стабілізація за допомогою внутрішньовенної інфузійної терапії та вазопресорів, переоцінка антибактеріальної терапії, повторне втручання у пацієнтів у критичному стані [1]. Сучасна антибіотикотерапія також не вирішує цю проблему радикально, що пов’язано зі стійкістю мікрофлори, а також з глибокими порушеннями обмінних процесів, зрушенням імунного статусу макроорганізму.
У цих умовах одного впливу на джерело запалення вже недостатньо. Потрібна патогенетична, науково обгрунтована, комплексна хірургічна програма. Позитивний результат лікування хворих з поширеними формами перитоніту на 80% залежить від оптимальної хірургічної тактики, впершу чергу, від адекватної санації черевної порожнин і лише на 20% – від антибактеріальної та інтенсивної терапії.
Контроль джерела при інтраабдомінальному сепсисі ґрунтується на чотирьох важливих елементах: санації, видаленні інфікованих пристроїв, дренуванні гнійних порожнин та декомпресії черевної порожниниі, передбачає усунення джерела інфекції, контроль зараження, що продовжується, та відновлення преморбідної анатомії та функції. Неадекватний початковий контроль джерела збільшує 28-денну смертність із 26,7% до 42,9%..[5]. Хворих із холангітом, викликаним обструкцією жовчовивідних шляхів, слід лікувати так само суворо, як і хворих із післяопераційним каловим перитонітом [7]. Хоча явне джерело інфекції у пацієнтів з бактеріємією може бути не ідентифіковано, у деяких ситуаціях, наприклад, при BSI, викликаному специфічними патогенами, такими як Staphylococcus aureus або Candida spp., може бути дисемінована інфекція, і слід провести ретельний пошук інфекційних вогнищ [7].
Використання серединної лапаротомії для оперативного втручання є загальноприйнятим, оскільки дозволяє провести повноцінну ревізію та санацію всіх відділів черевної порожнини. Після видалення джерела ГП проводиться заключна санація черевної порожнини, ефективність якої визначається ступінью бактеріальної контамінації перитонеального вмісту, характером мікрофлори з широким представленням анаеробів, швидкою зміною пріоритетних збудників, швидким розвитком резистентності мікрофлори до антибактеріальних препаратів і полягає у видаленні ексудату та патологічного вмісту з багаторазовим промивання черевної порожнини антисептичним розчинами до “чистої води”. Неповноцінна інтраопераційна санація не може бути замінена ні антибактеріальною терапією, ні інтенсивною терапією в післяопераційному періоді [2].
Існують міні-інвазійні підходи до діагностики та лікування АС, а саме лапароскопія в поєднанні з ультрасонографією та інтервальним перитонеальним лаважем. Суттєво вивченою є методика перитонеального лаважу як способу елімінації ексудату та антисептичного впливу на очеревину. Розроблено варіанти дренування черевної порожнини, режими її інтраопераційного лаважу та методи післяопераційних інтраабдомінальних інстиляцій, елімінація ексудату, програмовані лапароскопічні санації. Із метою моніторингу та декомпресії черевної порожнини застосовують методи MZT (Mesh-ZipperTechnique), VAC (Vacuum-Assisted Closure) і різних варіантів лапаростомії [3]. Чимало досліджень присвячено оцінці ефективності інтубації кишок як способу декомпресії травного тракту в рамках попередження абдомінального „компартмент”- синдрому або в комбінації із зондовим харчуванням чи введенням сорбентів, антисептиків та рідин з метою стимуляції кишкової перистальтики.
Цільовою групою Surviving Sepsis Campaign розглянуті три питання про рідини та вазопресори [4, 9]. Які ідеальні кінцеві точки для об’ємної реанімації та як слід титрувати рідину, об’ємна швидкість? Яка рідина є оптимальною для лікування сепсису? Який оптимальний підхід до вибору рідини, титрованої дози та ескалації вазопресорної терапії? Дорослим із сепсисом або септичним шоком рекомендують використовувати кристалоїди як рідину першого ряду для реанімації, саме збалансовані кристалоїди замість фізіологічного розчину.
Таким розчином є Рінгер малат ізотонічний, максимально наближений за своїм електролітним складом до плазми крові, має збалансований потенційний надлишок основ (BE = 0 ммоль/л), містить носії резервної лужності ацетат і малат, які повністю метаболізуються в еквівалентну кількість гідрокарбонату протягом короткого проміжку часу (60-90 хвилин) при цьому витрачаючи вдвічі меншу кількість кисню порівняно з метаболізмом лактату. У пацієнтівз сепсисом або септичним шоком, які отримували великі обсяги кристалоїдів, пропонують використовувати альбумін, но не рекомендують використовувати крохмалі, желатин [7].
Критерії адекватності інфузійної терапії при сепсисі та септичному шоці це відповідь на інфузійне навантаження. Якщо інфузійне навантаження збільшить серцевий викид пацієнта, він визнається таким, що відповідає на інфузійне навантаження (fluid responsive). Моніторинг SVV (варіація ударного об’єму) допомагає відповісти на найважливіше питання: який прогноз інфузійної терапії, серце чутливе до рідини чи ні.
Що до Hemodynamic management, то вазопресор першої лінії при сепсисі – норепінефрін. Адреналін або вазопресин згодом можуть бути додані для досягнення гемодинамічної мети. Комбінація норепінефрину та добутаміну порівняно з адреналіном не знижують смертність при септичному шоці на 28 добу. Два рандомізовані дослідження показали, що введення вазопресину при сепсисі не знижує смертність у порівнянні з норадреналіном. Оптимальну мету реанімації при сепсисі або септичному шоці ще потрібно визначити. Нормалізація рівня лактату, САТ від 65-70 мм рт.ст. до 80-85 мм рт. ст. при септичному шоці не призводить до зниження 28-денної смертності. Час до операції є незалежним предиктором клінічної невдачі у хворих на гостру ІАІ [9].
У Surviving Sepsis Campaign Guidelines 2021р. [9] рекомендується негайне введення антибіотиків пацієнтам із можливим септичним шоком або високою ймовірністю сепсису протягом 1 години з моменту першого виявлення сепсису. У пацієнтів з можливим сепсисом без шоку керівництва пропонують обмежений за часом курс швидкого обстеження та призначення антибіотиків протягом 3 годин після виявлення [Surviving Sepsis Campaign Guidelines 2021[9]. Правильна класифікація пацієнтів з ІАІ має вирішальне значення для оцінки тяжкості їхнього клінічного стану та вибору стратегії лікування, включаючи правильну емпіричну антибактеріальну терапію.
Визначено два типи IAI: позалікарняна (community-acquired intra-abdominal infection, CA-IAI) і внутрішньолікарняна hospital-acquired intra-abdominal infection, HA-IAI). CA-IAIмає яскраво виражену картину з лихоманкою та перитонеальними симптомами. Навпаки, перитонеальні симптоми менш виражені у пацієнтів із HA-IAI [10]. Антибіотики для емпіричного лікування CA-IAI повинні охоплювати кишкові грамнегативні аеробні та факультативні бактерії, кишкові грампозитивні стрептококи та облігатні анаеробні бацили, такі як Bacteroides fragilis (особливо для IAI, що походять з дистальних відділів тонкої кишки). Найбільш часто виділяється грамнегативний факультативний мікроорганізм Escherichia coli [1,10].
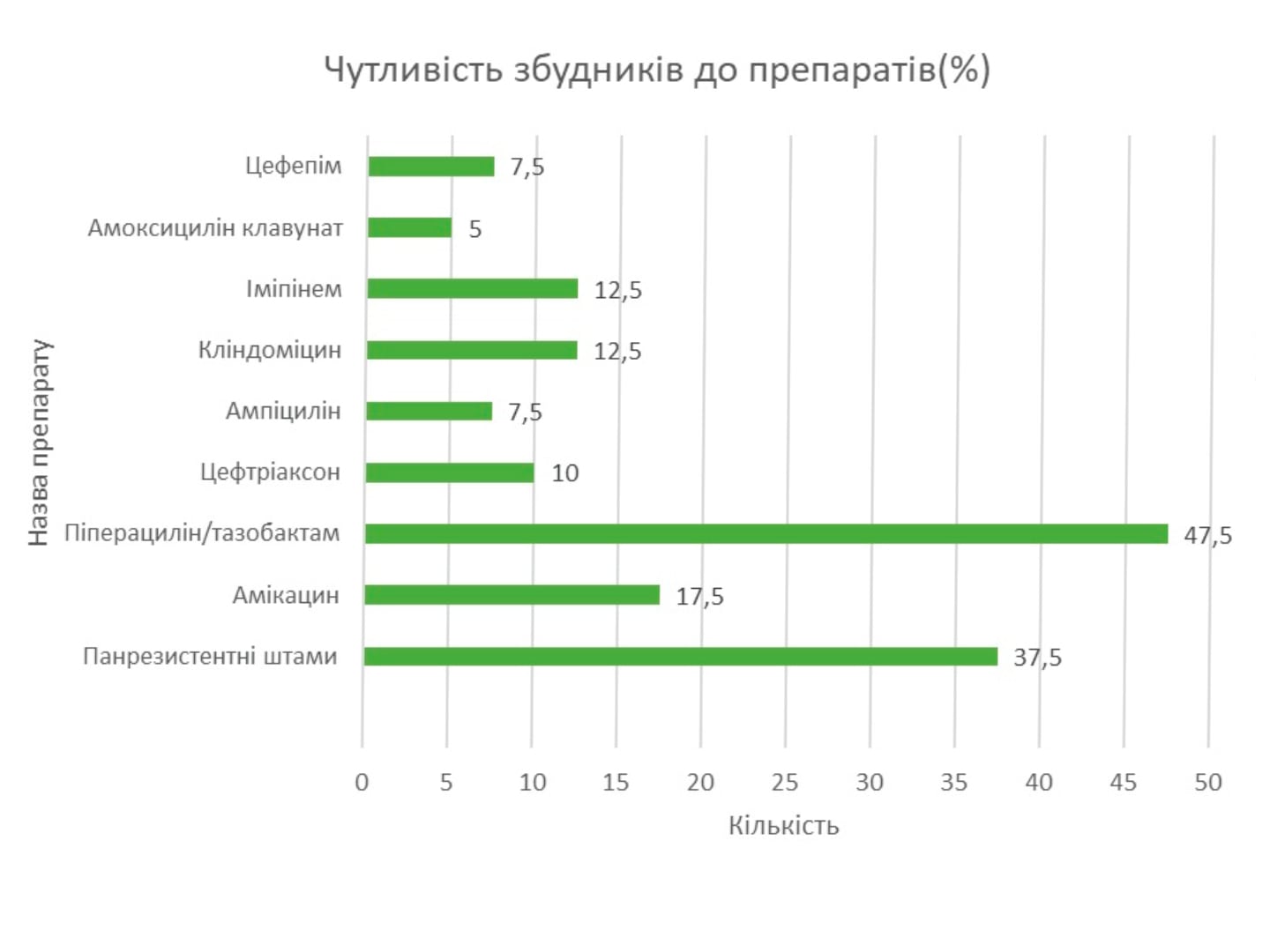
Через зростаючу поширеність ентеробактерій, стійких до амоксициліну/клавуланату, що спостерігаються при позалікарняних інфекціях, слід бути обережним при використанні амоксициліну/клавуланату в умовах високої місцевої резистентності до цього антибіотику. Однак більшість Enterobacterales залишаються чутливими до піперациліну/тазобактаму. Його активність широкого спектру дії робить його привабливим варіантом лікування CA-IAI, особливо у пацієнтів у критичному стані або у пацієнтів з CA-IAI з іншими факторами ризику несприятливих наслідків, включаючи літній вік, наявність злоякісного захворювання, серйозні порушення серцево-судинної, печінкової або ниркової функції, та гіпоальбумінемія [1, 10].
Більшість ізолятів E. coli та інших ентеробактерій при CA-IAI залишаються чутливими до цефалоспоринів третього покоління, які у поєднанні з метронідазолом можуть бути варіантами емпіричної терапії СА-ІАІ у пацієнтів без факторів ризику БЛРС.
В останні роки фторхінолони широко використовуються для лікування ІАІ через їх активність щодо аеробних грамнегативних бактерій та проникнення в тканини. Зростання резистентності E. coli та інших ентеробактерій у всьому світі обмежує використання фторхінолонів для емпіричного лікування CA-IAI, і їх зазвичай пропонують у поєднанні з метронідазолом і лише у некритичних пацієнтів з алергією на бета-лактамні агенти [11]. Карбапенеми вважаються емпіричними антибіотиками вибору для лікування пацієнтів з ESBL-продукуючих Enterobacterales.
Однак, щоб уникнути надмірного використання карбапенемів, слід розглянути карбапенем-зберігаючі стратегії з використанням інших антибіотиків, таких як піперацилін/тазобактам, аміноглікозиди, тигециклін або еравациклін. На активність піперациліну/тазобактаму впливає «ефект інокуляту» – лабораторний феномен, який описується як значне збільшення МІК антибіотика при інокуляції великої кількості бактерій. Хоча піперацилін/тазобактам не вважається антибіотиком першого вибору для лікування ентеробактерій, що продукують БЛРС, його все ж таки треба вважати цінним карбапенем-ощадним засобом при лікуванні БЛРС при ІАІ, які отримують адекватний контроль джерела при роботі з повністю чутливими бактерії. Високі дози (18 г) слід призначати для оптимізації націлення ФК/ФД у пацієнтів у критичному стані.
Аміноглікозиди мають активність in vitro щодо аеробних грамнегативних бактерій, у тому числі Enterobacterales, що продукують БЛРС, і діють синергічно щодо деяких грампозитивних бактерій. Через їх серйозні токсичні побічні ефекти, включаючи нефротоксичність та ототоксичність, деякі автори не рекомендують аміноглікозиди для рутинного емпіричного лікування ІАІ.
Тигециклін залишається корисним варіантом для лікування пацієнтів з ускладненими ІАІ через його сприятливу активність щодо анаеробних мікроорганізмів, ентерококів та БЛРС. Він не має активності in vitro щодо P. aeruginosa або деяких Enterobacterales, включаючи Proteus spp. та Serratia spp. У пацієнтів, які отримували тигециклін, спостерігалась підвищена смертність у порівнянні з іншими антибіотиками.
Еравациклін – антибіотик, структурно подібний до тигецикліну, має широкий спектр активності щодо грампозитивних, грамнегативних, у тому числі ентеробактерій, що продукують БЛРС, та анаеробних бактерій. Як і тигециклін, він неактивний щодо P. aeruginosa.
Нарешті, цефтолозан/тазобактам та цефтазидим/авібактам продемонстрували ефективність при лікуванні пацієнтів з ІАІ, спричиненими ентеробактеріями, які продукують БЛРС.
Серед грамнегативних бактерій, резистентних до карбапенемів, Enterobacterales є гетерогенною групою бактерій з більш потенційними механізмами стійкості до антибіотиків. Зазвичай їх ділять на ентеробактерії, що продукують карбапенемазу, та ентеробактерії, що не продукують карбапенемазу. Карбапенемази гідролізують пеніциліни, цефалоспорини, інгібітори бета-лактамаз і навіть карбапенеми. Метало-бета-лактамази (MBL) відрізняються від інших бета-лактамаз потребою в цинку для своєї активності. Всі MBL здатні гідролізувати більшість бета-лактамних агентів, включаючи карбапенеми, за винятком монобактаму азтреонаму.
Тривожні показники стійкості до багатьох антибіотиків у медичних закладах по всьому світу були зареєстровані для неферментуючих грамнегативних бактерій, включаючи P. aeruginosa, Stenotrophomonas maltophilia та Acinetobacter baumannii. У P. aeruginosa були ідентифіковані різні механізми резистентності, включаючи дефекти проникності мембран, експресію насосів відтоку та вироблення ферментів, що гідролізують антибіотики, таких як бета-лактамази AmpC або карбапенемази. Найбільш поширеними карбапенемазами P. aeruginosa є MBL, такі як метало-β-лактамаза, що кодується інтегронами Verona (VIM), і іміпенемази (IMP).
В останні роки кілька нових антибіотиків з переважною активністю проти грамнегативних бактерій було схвалено FDA та EMA. Меропенем/ваборбактам, цефтазидим/авібактам, та іміпенем/циластатин/релебактам є варіантами терапії карбапенемазопродукуючої інфекції K. Pneumoniae [11]. Цефідерокол ефективний invitro проти всіх фенотипів резистентності P. aeruginosa, включаючи MBL.
У пацієнтів з ІАІ все частіше зустрічається Enterococcus faecium, особливо у пацієнтів з НА-ІАІ. На відміну від E. faecalis майже всі штами E. faecium стійкі до ампіциліну. Лікування чутливих до ванкоміцину штамів E. faecium першої лінії включає ванкоміцин або інші глікопептиди. Лінезолід і даптоміцин можуть використовуватися для лікування підозрюваних або підтверджених інфекцій, спричинених VRE [11].
Існує міжнародний міждисциплінарний консенсус лікування поверхневої та глибокої інфекції в галузі хірургічного втручання (surgical site infection, SSIs). За чотирма пунктами, що стосуються оцінки стану рани через 3 дні після початку антибіотикотерапії, було досягнуто консенсусу: повторна оцінка через 3 дні після початку антибіотикотерапії; зміна антибіотикотерапії за відсутності поліпшення; оцінка відповіді лікування на підставі життєво важливих параметрів пацієнта; оцінка на підставі зменшення розмірів ураження шкіри. Що до антибіотикотерапії для пацієнтів з SSIs, то немає консенсусу, чи слід призначати емпіричну антибіотикотерапію протягом 14 днів незалежно від необхідності дренування [12].
Ефективне проведення антибактеріальної терапії при третинному перитоніті – дуже складна проблема, потрібна ефективна протимікробна терапія проти патогенів із множинною лікарською стійкістю. Попередня антимікробна терапія та вплив середовища змінюють мікробіологічну колонізацію пацієнтів. Інтраабдомінальна інфекція (IAIs) при третинному перитоніті з більшою ймовірністю це нозокоміальні бактерії. Грибки нерідко є патогенами серед пацієнтів із ураженням кишечника, нозокоміальною інфекцією, попередньою дією антибіотиків, імунодефіцитними станами.
Концентрація антибіотика у вогнищі інфекту може бути низькою та неефективною для лікування перитоніту, сепсису. Режим дозування антибіотиків – на підставі вимірювання динаміки їхнього вмісту в плазмі.
Деескалація антибіотиків нині вважається ключовим моментом програм раціонального використання протимікробних препаратів у відділеннях інтенсивної терапії. Адекватне дозування пов’язане з концепцією знищення залежно від часу та концентрації [11].
Огляд антимікробної терапії хворих із вторинними та/або третинним розповсюдженим перитонітом за даними Guidelines of the Paul-Ehrlich Society постулює антибіотики широкого спектру відповідно для вторинного перитоніту: піперацилін/тазобактам, ертапенем, тігециклін, моксифлоксацин, цефазоліна тазобактам+метронідозол. Та для третинного перитоніту лінезолід в поєднанні з карбапенемами і цефалоспоринами [5].
При вторинному перитоніті рекомендовано такі дози Піперациліну/тазобактаму: 6 г/0,75 г LD, потім 4 г/0,5 г кожні 6 годин або 16 г/2 г шляхом безперервної інфузії (у пацієнтів у критичному стані).[13]. Guidelines for treatment of intra-abdominal infections in adults Michigan Medicine University, 2020 [11,13] пропонують схему лікування вторинного перитоніту (інфекція, пов’язана з перфорацією або потраплянням збудників шлунково-кишкового тракту в черевну порожнину) – EmpiricTherapy. Позалікарняний вторинний перитоніт, без важкого сепсису/шоку: 1-й рядок- Цефуроксим 1,5 г в/в кожні 8 год+ Метронідазол 500 мг перорально/в/в кожні 8 год. Якщо є алергія високого ризику/протипоказання до бета-лактамів, то призначають Ципрофлоксацин 400 мг в/в кожні 8 год + Метронідазол 500 мг перорально/в/в кожні 8 год.
Позагоспітальний вторинний перитоніт із важким сепсисом/шоком або ризиком MDR-GNR: 1-й рядок- Піперацилін-тазобактам 4,5 г в/в кожні 6 год. Якщо є алергія на пеніциліни низького/середнього ризику то призначають Цефепім 2 г в/в кожні 8 год+ Метронідазол 500 мг перорально/в/в кожні 8 год. Можливо додавання ванкоміцину до цефепіму для охоплення пацієнтів з Enterococcus у критичному стані. Якщо є алергія високого ризику/протипоказання до бета-лактамів, то призначають Ванкоміцин+ Азтреонам 2 г в/в кожні 8 год+ Метронідазол 500 мг перорально/в/в кожні 8 год.
Третинний перитоніт(стійка інфекція, пов’язана з повторюваною перфорацією шлунково-кишкового тракту та/або розривом анастомозу після первинного лікування вторинного перитоніту) – Empiric Therapy: 1-й рядок:
Піперацилін-тазобактам 4,5 г в/в кожні 6 год. Якщо є алергія на пеніциліни низького/середнього ризику, то призначають Цефепім 2 г в/в кожні 8 год+ Метронідазол 500 мг перорально/в/в кожні 8 год. Можливододавання ванкоміцину до цефепіму для охоплення пацієнтів з Enterococcusу критичному станіз факторами ризику.
Якщо є алергія високого ризику/протипоказання до бета-лактамів то призначають Ванкоміцин+ Азтреонам 2 г в/в кожні 8 год+ Метронідазол 500 мг перорально/в/в кожні 8 год.Емпірична терапія повинна враховувати попередні культуральні дослідження та ступінь тяжкості проявив (особливо наявність тяжкого сепсису/шоку). Обидва фактори можуть диктувати альтернативні емпіричні методи лікування з перерахованих вище. Існуючі дренажі часто колонізовані, і їх не слід культивувати.
З описаного вище, емпірична антибактеріальна терапія ускладнених інтраабдомінальних інфекцій (УІАІ) може мати декілька варіантів. Все залежить від виду УІАІ (позалікарняна/лікарняна), стану пацієнта, ймовірного збудника, попереднього лікування, наявності алергій тощо. Проте світові стандарти все більше схиляються до піперациліну/тазобактаму емпірично та з 2017 року ВООЗ затвердила молекулу піперациліну/тазобактаму як препарат першої лінії у лікуванні УІАІ (перитоніт та перитонеальний абсцес) та нейтропенії. В Україні згідно національного переліку лікарьских засобів – піперацилін/тазобактам також внесений як препарат першої лінії у лікуванні УІАІ.
У 2022 р. на ринку України з’явився перший вітчизняний піперацилін/тазобактам (ПТЗ) під назвою «РЕФЕКС» виробництва компанії «Юрія-фарм». 1 флакон препарату у дозі 4,5 (4 г/0,5 г). Показання для застосування це інфекції спричинені чутливими до препарату штамами мікроорганізмів.
Дорослим та дітям віком від 12 років: тяжка пневмонія, у тому числі нозокоміальна та вентилятор-асоційована пневмонія); ускладнені інфекції сечовидільної системи, у тому числі пієлонефрит; ускладнені інфекції шкіри і м’яких тканин; ускладнені внутрішньочеревні інфекції; септицемія; бактеріальні інфекції у хворих з нейтропенією та лихоманкою при підозрі на бактеріальну інфекцію. Дозу визначають індивідуально в кожному конкретному випадку залежно від перебігу та локалізації інфекції, а також ймовірних збудників. Вводити повільно як внутрішньовенну інфузію протягом 20 – 30 хвилин. Для дорослих та дітей віком від 12 років з нормальною функцією нирок звичайна доза становить 4,5 г Рефексу (4 г піперациліну/0,5 г тазобактаму) кожні 8 годин.
Передопераційна підготовка хворого з перитонітом визначається не часом і не об’ємом, а її якістю. Показник – виведення хворого на стабільне плато протягом 2х-3х годин передопераційне введення антибіотиків.
Основний метод знеболювання при операціях з приводу перитоніту – багатокомпонентна збалансована анестезія із застосуванням м’язових релаксантів та ШВЛ. Останнім часом стала широко застосовуватися перидуральна та спинномозкова анестезія. При будь-якому варіанті загальної анестезії хірург повинен виконувати інтраопераційну новокаїнову блокаду рефлексогенних зон та кореня брижі тонкої, поперечно-ободової та сигмовидної кишки. Операція складається з семи послідовно виконуваних етапів: оперативний доступ, новокаїнова блокада рефлексогенних зон, усунення або надійна ізоляція джерела перитоніту, санація черевної порожнини, декомпресія кишечника, дренування черевної порожнини, ушивання лапаротомної рани.
Принципи антибактеріальної терапії: якщо операція триває більше 3-х годин, то через 3 години введення антибіотиків повторюється; в екстреному порядку застосовується емпірична антибіотикотерапія до того моменту, поки не визначиться чутливість мікроорганізмів за результатами посіву.
Методики завершення операції: зашивання рани наглухо без дренажів; зашивання рани з пасивним дренуванням; зашивання з дренажами для промивання; (лаважу) проточного і фракційного; зближення країв рани (напівзакритий метод) для дорзовентрального промивання з аспірацією відтікаючої рідини через серединну рану; зближення країв рани за допомогою різних пристроїв з повторними ревізіями та санаціями (лапароперція). Синдром інтраабдомінальної гіпертензії (СІАГ, Abdominal Compartment Syndrome), при наявності якого стала застосоватися методика відкритого ведення черевної порожнини – «Open abdomen».
Методика «Openabdomen» поступається місцем первинному глухому шву передньої черевної стінки й гострота дискусії зміщується до питань більш раціонального дренування, санації та післяопераційного ведення. Використовують методику вимірювання внутрішньочеревного тиску через сечовий міхур, яку вважають «золотим» стандартом моніторингу внутрішньочеревного тиску. Abdominal Compartment Syndromeє грізним ускладненням РГП, що значно підвищує рівень летальності. Успішне купування симптомів Abdominal Compartment Syndromeна тлі важкого перитоніту можливо за умови застосування методики «Open abdomen». VAC-терапія – негативний тиск, режим постійний, час 24 години.
Використання VAC-терапії в поєднанні з методикою «Open abdomen» призводить до стійкого зниження як ВЧТ, так і до купування явищ гнійного запалення в черевній порожнині [14] Закриття черевної порожнини проводять у момент коли інтраабдомінальни ознаки інфекції клінічно не виявляються. (фібриновий покрив кишечнику, гній, каламутна рідина). Якщо фасція виглядає стабільною, закриття без натягу можливо, виконують пряме закриття з монофілом, що розсмоктується. Якщо це неможливо, використовується сітка, що розсмоктується. Якщо потрібне додаткове кондиціювання рани використовують підшкірну терапію негативним тиском.
Автор: Черній В.І., Державна наукова установа «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами, м. Київ.
Висновки:
Гострий розповсюджений перитоніт все ще асоціюється із високою захворюваністю та смертністю. Ефективне лікування ІАІ – раннє розпізнавання та усунення джерела, промивання черевної порожнини, виведення ексудату і міждисциплінарне лікування антибіотиками в умовах інтенсивної терапії.
Література:
- Sartelli et al. WSES/GAIS/SIS-E/WSIS/AAST global clinical pathways for patients with intra-abdominal infections World Journal of Emergency Surgery (2021) 16:49, doi.org/10.1186/s13017-021-00387-8.
- Гудзь М.А. Динаміка імуно-цитокінового профілю в прогнозуванні перебігу та виборі лікувальної тактики гнійного перитоніту.дисертація на здобуття наукового ступеня кандидата медичних наук,Вінниця – 2016. 305 с.
- Матвійчук О. Б. Третинний перитоніт – клініка, діагностика, лікування. Дисертація на здобуття наукового ступеня доктора медичних наук за спеціальністю 01.03 – хірургія (22 Охорона здоров’я). –Львів, 2018.
- M. Singer et al The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016. ;315(8):801-810. doi:10.1001/jama.2016.0287.
- A. Hecker et al Intra-abdominal sepsis: new definitions and current clinical standards Archives of Surgery(2019) 404:257–271, doi.org/10.1007/s00423-019-01752-7.
- Невідкладна хірургія органів черевної порожнини (стандарти організації та професійноорієнтовані алгоритми надання медичної допомоги) / За ред. Фоміна П.Д., Усенко О.Ю., Березницького Я.С. – К.: Бібліотека «Здоров’я України», 2018. – 354 с.
- J. J. DeWaele, M. Girardis, I. Martin‑Loeches Source control in the management of sepsis and septic shock. Intensive Care Med (2022) 48:1799–1802, doi.org/10.1007/s00134-022-06852-5.
- Marques H.S. et al Tertiary peritonitis: A disease that should not be ignored. World J Clin Cases 2021; 9(10): 2160-2169. DOI: doi.org/10.12998/wjcc.v9.i10.2160
- Evans et al Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med (2021) 47:1181–1247, doi.org/10.1007/s00134-021-06506-y
- Т.Abaziou et al. Outcome of community- versus hospitalacquired intra-abdominal infections in intensive care unit: a retrospective study.BMC Anesthesiology (2020) 20:295,org/10.1186/s12871-020-01209-1/
- M. Sartelli et alA Proposal for a Classification Guiding the Selection of Appropriate Antibiotic Therapy for Intra-Abdominal Infections. ReviewAntibiotics (Basel).2022 Oct 12;11(10):1394, doi: 10.3390/antibiotics].
- Gabriele Sganga et al Management of superficial and deep surgical site infection: an international multidisciplinary consensus. UpdatesSurg.2021 Aug;73(4):1315-1325.doi: 10.1007/s13304-021-01029-z. Epub 2021 Mar 26.
- Sartelli et al Classification proposal for selecting appropriate antibiotic therapy for intra-abdominal infections. Overview of Antibiotics (Basel). Antibiotics.2022 October 12; 11 (10): 1394. doi: 10.3390/antibiotics11101394.
- В. В. Грубник, В. М. Косован, Є. А. Койчев, М. М. Чернов Успішне лікування важкого гнійного перитоніту, ускладненого синдромом інтраабдомінальної гіпертензії (клінічний випадок). харківська хірургічна школа № 5–6 (110–111) 2021, doi:doi.org/10.37699/2308-7005.5-6.2021.13.